解答:
解:(1)Cu、Fe两种元素的质量比为8:7,则X中:n(Cu):n(Fe)=
:
=1:1,设每等份溶液中含有铜离子、铁离子的物质的量为x,向其中一份加入足量稀NaOH溶液,搅拌,过滤、洗涤、灼烧,得粉末4.8g,4.8g为氧化铁、氧化铜的混合物,根据质量守恒可得:80x+
x×160=4.8,解得x=0.03mol,即n(Cu)=n(Fe)=0.03mol;
向另一份溶液中加入足量Ba(NO
3)
2溶液,得沉淀13.98g,沉淀为硫酸钡,根据质量守恒,则n(S)=n(BaSO
4)=
=0.06mol,
该黄铜矿中Cu、Fe、S的物质的量之比为:0.03mol:0.03mol:0.06mol=1:1:2,最简式为:CuFeS
2,设X的化学式为:(CuFeS
2)
n,则(64+56+32×2)×n=368,解得:n=2,故X的化学式为Cu
2Fe
2S
4;
A.复盐可以电离出两种金属离子(包括铵根离子),冰晶石电离出的是钠离子和六氟合铝酸根离子,化学式[AlF
6]
3-,带三个负电荷,不符合复盐的特点,故A错误;
B.KAl(SO
4)
2?12H
2O溶于水电离出钾离子和铝离子,所以明矾为复盐,故B正确;
C.Ca(NO
3)Cl溶于水电离出的阳离子只有钙离子,不满足复盐的特点,故C错误;
D.(NH
4)
2SO
4?FeSO
4?6H
2O溶于水能够电离出铵根离子和铁离子,满足复盐的特点,故D正确;
故答案为:Cu
2Fe
2S
4或 Cu
2S?Fe
2S
3;BD;
(2)根据计算可知,X的化学式为:Cu
2Fe
2S
4,Cu
2Fe
2S
4与浓硝酸反应生成铁离子、铜离子、硫酸根离子、二氧化氮气体和水,反应的离子方程式为:Cu
2Fe
2S
4+36H
++34NO
3-=2Cu
2++2Fe
3++4SO
42-+34NO
2↑+18H
2O,
故答案为:Cu
2Fe
2S
4+36H
++34NO
3-=2Cu
2++2Fe
3++4SO
42-+34NO
2↑+18H
2O;
(3)杂质铁优先放电生成亚铁离子:Fe-2e
-=Fe
2+,然后铜放电生成铜离子:Cu-2e
-=Cu
2+,而Ag、Au的活泼性小于铜,电解过程中不放电,沉淀下来变成电解泥,
故答案为:Cu-2e
-=Cu
2+、Fe-2e
-=Fe
2+;
(4)Cu
2+与少量氨水反应生成氢氧化铜沉淀,当氨水过量时,氢氧化铜沉淀溶解,所以铜离子与过量氨水反应的离子方程式为:Cu
2++4NH
3?H
2O=Cu(NH
3)
42++4H
2O,
故答案为:Cu
2++4NH
3?H
2O=Cu(NH
3)
42++4H
2O;
(5)CuCl
2具有较强的共价性,无水CuCl
2为无限长链的聚合物结构,每个Cu原子处于4个Cl原子形成的正方形的中心,则它的长链结构片段(含3个Cu原子的片段)为:
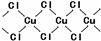
,故答案为:

;
(6)验证某种青瓷釉中含有四氧化三铁,可以分别检验亚铁离子和铁离子即可,方法为:取少量青瓷釉样品于研钵研碎,转移到小烧杯,加入盐酸溶解,静置;取两份上层清液于试管,一份中加入KSCN溶液,出现红色,说明有Fe
3+;另一份加入酸性KMnO
4溶液,紫红色褪去,说明含有Fe
2+,
故答案为:取少量青瓷釉样品于研钵研碎,转移到小烧杯,加入盐酸溶解,静置;取两份上层清液于试管,一份中加入KSCN溶液,出现红色,说明有Fe
3+;另一份加入酸性KMnO
4溶液,紫红色褪去,说明含有Fe
2+.

 ,故答案为:
,故答案为: ;
;

 2013年12月2日我国成功发射的“嫦娥三号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:SiO2+C+N2
2013年12月2日我国成功发射的“嫦娥三号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:SiO2+C+N2 氧族元素的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含氧族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
氧族元素的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含氧族元素的化合物在研究和生产中有许多重要用途.请回答下列问题: