
【题目】下列说法正确的是
A.合金比成分金属熔点高、硬度大
B.钠具有强还原性,可置换出四氯化钛溶液中的钛
C.用原子吸收光谱能确定物质中是否含有哪些金属元素
D.镁的熔点高达2800℃,是优质的耐高温材料
科目:高中化学 来源: 题型:
【题目】工业上制备 BaCl2·2H2O 有如下两种途径。
途径 1:以重晶石(主要成分 BaSO4)为原料,流程如下:
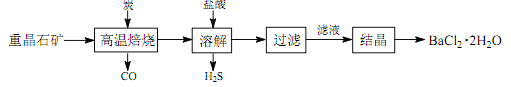
(1)写出“高温焙烧”时反应的化学方程式: _____________________________________。
(2)“高温焙烧” 时必须加入过量的炭,同时还要通入空气,其目的是____________。
途径 2:以毒重石(主要成分 BaCO3,含 Ca2+、 Mg2+、 Fe3+等杂质)为原料,流程如下:
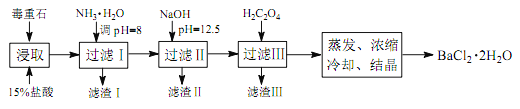
已知: Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的 pH | 13.9 | 11.1 | 3.7 |
(3)为提高矿石的浸取率,可采取的措施是_________。
(4)加入 NH3·H2O 调节 pH=8 可除去____ (填离子符号),滤渣Ⅱ中含_________(填化学式)。加入 H2C2O4时应避免过量,原因是_________。
(5)重量法测定产品纯度的步骤为:
准确称取 m g BaCl2·2H2O 试样,加入 100 mL 水, 用 3 mL 2 mol·L-1 的 HCl 溶液加热溶解。边搅拌,边逐滴加入 0.1 mol·L-1 H2SO4 溶液。待 BaSO4 完全沉降后,过滤,用0.01 mol·L-1 的稀H2SO4洗涤沉淀 3~4 次,直至洗涤液中不含 Cl-为止。将沉淀置于坩埚中经烘干灼烧至恒重,称量为 n g。则BaCl2·2H2O的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2CO3溶液中存在如下反应:CO ![]() +H2O═HCO
+H2O═HCO ![]() +OH﹣下列说法中正确的是( )
+OH﹣下列说法中正确的是( )
A.溶液中加水, ![]() 增大
增大
B.加入Na2CO3固体, ![]() 减小
减小
C.升高温度,平衡常数减小
D.通入CO2 , 溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.固体氯化钠不导电,所以氯化钠是非电解质
B.铜丝能导电,所以铜是电解质
C.氯化氢水溶液能导电,所以氯化氢是电解质
D.SO3溶于水能导电,所以SO3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.下列说法正确的是( ) 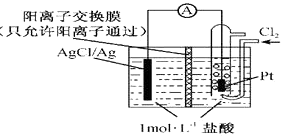
A.正极反应为AgCl+e﹣=Ag+Cl﹣
B.放电时,交换膜左侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01mole﹣时,交换膜左侧溶液中约减少0.01mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验: 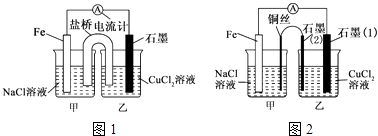
(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为 . 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过mol电子.
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式 , 这是由于NH4Cl溶液显(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因 .
(3)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨为极(填正、负、阴、阳),乙装置中与铜线相连的石墨(2)电极上发生的反应式为 .
(4)在图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质量增重 1.28g,则此时溶液的pH为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由富锰渣(含2MnO·SiO2、3MnO·Al2O3·3SiO2、FeO及重金属盐等)制备高纯MnCl2的工艺流程如下:

回答下列问题:
(1)“浸取”时的温度与四种元素的浸取率如图所示。

①工艺上控制75℃的主要原因是____________________________________________。
②铁和铝的浸出率从72℃明显下降的可能原因是___________________________________。
(2)“氧化”时发生反应的离子方程式为___________________________________________。
(3)通过调整pH可以“除铁和铝”。常温下,三种氢氧化物开始沉淀和沉淀完全(使其浓度小于1×10-6mol/L)的部分数据如下表:
Mn(OH)2 | Fe (OH)3 | Al(OH)3 | |
开始沉淀pH | 7.1 | 2.2 | 4. 1 |
沉淀完全pH | 10.8 | 3.5 | ? |
Al(OH)3沉淀完全的pH为______________{已知Ksp[Al(OH)3]=1×10-33};“调pH”时,应将溶液pH调整的范围是______________________。
(4)“除重金属”时,发生反应Hg2++MnS![]() HgS+M2+,其平衡常数K=___________[已知溶度积常数Ksp(HgS)=1.6×10-52,Ksp(MnS)=2.5×10-10,答案保留三位有效数学]。
HgS+M2+,其平衡常数K=___________[已知溶度积常数Ksp(HgS)=1.6×10-52,Ksp(MnS)=2.5×10-10,答案保留三位有效数学]。
(5)“步骤X”包含的操作有蒸发浓缩、__________、洗涤、干燥等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 molX和2molY充入2L密闭容器中发生如下反应:X(气)+3Y(气)![]() 2Z(气)+aQ(气)2min达到平衡时生成0.8molZ,测得Q的浓度为0.4mol/L,下列叙述错误的是( )
2Z(气)+aQ(气)2min达到平衡时生成0.8molZ,测得Q的浓度为0.4mol/L,下列叙述错误的是( )
A.a的值为2
B.平衡时X的浓度为0.8mol/L
C.Y的转化率为60%
D.反应速率v(Y)=0.6mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期的元素X、Y、Z、W、M的原子序数依次增大,元素X与W位于同一主族,Z元素的单质既能与盐酸反应也能与NaOH溶液反应,W原子的最外层电子数是次外层电子数的一半,M的最高正价与最低负价的绝对值之差为4,五种元素原子的最外层电子数之和为19,下列说法正确的是![]()
A. W和X的简单气态氢化物的稳定性前者更强
B. 室温下,![]() 的M的气态氢化物的水溶液的
的M的气态氢化物的水溶液的![]()
C. 简单离子半径由大到小的顺序:![]()
D. Y、Z元素的单质作电极,在NaOH溶液环境下构成原电池,Z电极上产生大量气泡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com