
| A. | NO2+H2O | B. | Cl2+H2O | C. | Na+H2O | D. | SO2+H2O |
分析 水中H元素的化合价降低,则水为氧化剂,若水中O元素的化合价升高,则水为还原剂,以此来解答.
解答 解:A、3NO2+H2O=2HNO3+NO中,N元素的化合价由+4价变为+5价和+2价,水中H、O元素的化合价不变,所以该反应是氧化还原反应,但水既不是氧化剂又不是还原剂;
B、Cl2+H2O=HCl+HClO中,水中H、O元素的化合价不变,Cl元素的化合价由0价变为+1价和-1价,所以该反应是氧化还原反应,但水既不是氧化剂又不是还原剂;
C、2Na+2H2O=2NaOH+H2↑中,水中H元素的化合价降低,则水为氧化剂;
D、SO2+H2O=H2SO3中,过水中H、O元素的化合价不变,所以该反应是氧化还原反应,但水既不是氧化剂又不是还原剂;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意水中H、O元素的化合价分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在Na2A、NaHA两溶液中,离子种类不相同 | |
| B. | 在溶质的物质的量相等的Na2A,NaHA两溶液中,阴离子总数相等 | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) | |
| D. | 在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
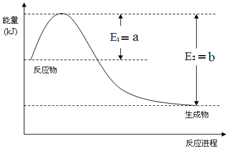 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸和氢氧化钠 | B. | 盐酸和氨水 | C. | 硫酸和氢氧化钾 | D. | 醋酸和氢氧化钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸分子中均含有一OH,均可与NaOH反应 | |
| B. | 甲烷和乙烯均能使酸性的高锰酸钾溶液褪色 | |
| C. | 苯分子是一种单双键交替排列的特殊结构,所以既可发生取代又能加成反应 | |
| D. | 煤和石油均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
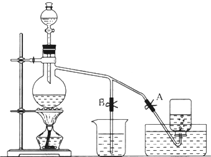 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com