
【题目】下列物质 ①Cu;②液态SO2;③纯醋酸;④NaHCO3;⑤Ba(OH)2溶液;⑥酒精。
I.属于非电解质的是_______________________;(填序号)
Ⅱ.(1)NaHCO3是一种 _________________(填“强”或“弱”)电解质;
(2)写出HCO3-水解的离子方程式:_____________________________________;
(3)常温下,0.1 mol/LNaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为:________________________。
III.Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
(1)该Ba(OH)2溶液的物质的量浓度为___________________;
(2)溶液中由水电离出c(OH-)=______________;
(3)与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
【答案】②⑥ 强 HCO3-+H2O![]() H2CO3+OH- c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-) 0.05 mol/L 1.0×10-13 mol/L 2
H2CO3+OH- c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-) 0.05 mol/L 1.0×10-13 mol/L 2
【解析】
I.水溶液中和熔融状态都不导电的化合物称为非电解质;
Ⅱ.(1)在溶液中能够完全电离的电解质为强电解质,不能完全电离的为弱电解质;
(2)HCO3-水解生成碳酸和氢氧根离子;
(3)0.1 mol/LNaHCO3溶液的pH大于8,说明碳酸氢根离子的水解程度大于电离程度;
Ⅲ.(1)Ba(OH)2是一种强电解质,完全电离,1 mol Ba(OH)2电离产生2 mol OH-,所以c(OH-)=2c[Ba(OH)2],据此解答;
(2)Ba(OH)2溶液中氢离子都是由水电离产生,水电离产生的c(OH-)等于溶液中水电离出c(H+);
(3)设盐酸的物质的量浓度为:c(HCl),碱与酸体积分别为1 L、9 L,分别求出氢氧化根离子和氢离子的物质的量,二者发生酸碱中和,所得溶液pH=11可知碱剩余,求出剩余的氢氧根离子的物质的量,依据:Kw= c(H+)·c(OH-)计算解答。
I.①Cu是金属单质,不属于电解质,也不属于非电解质;
②液态SO2由分子构成,在水溶液反应产生的H2SO3电离产生离子而导电,SO2不能电离产生离子,在熔融状态也不能电离,因此是不导电的化合物,属于非电解质;
③纯醋酸由分子构成,在水中能够电离产生自由移动的离子而导电,属于电解质;
④NaHCO3、⑤Ba(OH)2都是离子化合物,在水溶液中或熔融状态下能够导电属于电解质;
⑥酒精由分子构成,在水溶液或熔融状态下都不能够电离产生自由移动的离子,因此属于非电解质;
故属于非电解质的物质序号为②⑥;
Ⅱ.(1)NaHCO3是盐,在溶液中能够完全电离的电解质,属于强电解质;
(2)HCO3-水解,消耗水电离产生的H+,生成碳酸和氢氧根离子,水解的离子方程式为:HCO3-+H2O![]() H2CO3+OH-;
H2CO3+OH-;
(3)常温下,0.1 mol/LNaHCO3溶液的pH大于8,c(OH-)>c(H+),说明HCO3-水解程度大于其电离程度,HCO3-由于水解和电离而消耗,则c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),但盐水解程度是微弱的,主要以盐电离产生的离子存在,所以c(HCO3-)>c(H2CO3)、c(HCO3-)> c(OH-),溶液中氢氧根来源于水的电离与HCO3-水解,则c(OH-)>c(H2CO3),因此溶液中微粒浓度关系为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-);
Ⅲ.(1)pH=13的Ba(OH)2溶液,c(H+)=10-13 mol/L,c(OH-)=![]() =0.1 mol/L,所以c[Ba(OH)2] =0.5×c(OH-)=0.05 mol/L;
=0.1 mol/L,所以c[Ba(OH)2] =0.5×c(OH-)=0.05 mol/L;
(2)pH=13的Ba(OH)2溶液中氢离子全部由水电离产生,又因为由水电离出c(OH-)与由水电离产生c(H+)相等,故水电离出c(OH-)= c(H+)=10-13 mol/L;
(3)设盐酸的物质的量浓度为c(HCl),碱与酸体积分别为1 L、9 L,则n(OH-)=0.1mol/L×1 L=0.1 mol,n(H+)=c(HCl)×9 L,反应后剩余氢氧根离子的物质的量为:0.1 mol-c(HCl)×9 L;
由混合所得溶液pH=11,可知混合后c(H+)=10-11 mol/L,则混合后c(OH-)=![]() =10-3 mol/L,即:
=10-3 mol/L,即:![]() =10-3 mol/L,解得:c(HCl)=10-2 mol/L,根据pH=-lg c(H+),所以HCl溶液的pH=2。
=10-3 mol/L,解得:c(HCl)=10-2 mol/L,根据pH=-lg c(H+),所以HCl溶液的pH=2。


科目:高中化学 来源: 题型:
【题目】高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂。下图是在实验室中制备KMnO4晶体的流程:
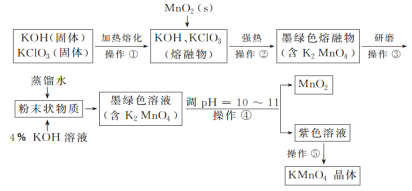
回答下列问题:
(1)操作②的目的是获得K2MnO4,同时还产生了KCl和H2O,试写出该步反应的化学方程式:____,操作①和②均需在坩埚中进行,根据实验实际应选择____(填序号)。
a.瓷坩埚 b.氧化铝坩埚 c.铁坩埚 d.石英坩埚
(2)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为_________。
若溶液碱性过强,则MnO4—又会转化为MnO42—,该转化过程中发生反应的离子方程式为________,因此需要通入某种气体调pH=10~11,在实际操作中一般选择CO2而不是HCl,原因是______________。
(3)操作⑤过滤时,选择图2所示装置而不用图1所示装置的原因是________。
图1 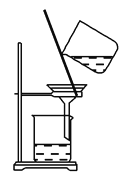 图2
图2 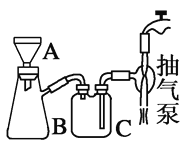
(4)还可采用电解K2MnO4溶液(绿色)的方法制造KMnO4(电解装置如图所示),电解过程中右侧石墨电极的电极反应式为_____,溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能的原因是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是

A. 甲为正极,丙为阴极
B. 丁极的电极反应式为MnO42――e-===MnO4-
C. KOH溶液的质量分数:c%>a%>b%
D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4molK+移入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,不正确的是( )

A.HA的电离方程式为:HA=H++A- B.MOH为一元弱碱
C.K点对应的溶液中有:c(MOH)+c(M+)=0.02mol ![]() L-1 D.N点对应的溶液中有:c(M+)=c(A-)
L-1 D.N点对应的溶液中有:c(M+)=c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种一元酸溶液各1mL, 分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示, 则下列说法正确的是

A. A、B两种酸溶液物质的量浓度一定相等
B. 稀释后A酸溶液的酸性比B酸溶液强
C. a = 5时, A是弱酸, B是强酸
D. 若A、B都是弱酸, 则5 > a > 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,AgI饱和溶液中c(Ag+)为1.23×10-8mol·L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5mol·L-1。若在5 mL含有KCl和KI各为0.01 mol·L-1的溶液中,加入8 mL 0.01 mol·L-1AgNO3溶液,下列叙述正确的是( )
A.混合溶液中c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
B.混合溶液中c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
C.加入AgNO3溶液时首先生成AgCl沉淀
D.混合溶液中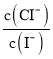 约为1.02×10-3
约为1.02×10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒容的条件下对于N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为
2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为
A.断开一个N≡N键的同时有6个N—H键生成
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.N2、H2、NH3分子数之比为1∶3∶2的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.1mol/LCH3COOH溶液中逐渐加入NaOH固体,恢复至原温度后溶液中的关系如图所示(忽略溶液体积变化)。下列有关叙述不正确的是( )

A.CH3COOH的Ka=1.0×10-4.7
B.C点的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.B点的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
D.A点的溶液中:c(CH3COO-)+c(H+)+c(CH3COOH)-c(OH-)=0.1mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com