
| A. | 150 mL3 mol•L-1氯酸钠溶液 | B. | 75 mL 3 mol•L-1氯化钙溶液 | ||
| C. | 150 mL 3 mol•L-1氯化钾溶液 | D. | 50 mL 3 mol•L-1氯化镁溶液 |
分析 根据离子的物质的量浓度=溶质的物质的量浓度×一个溶质中含有离子的个数,与溶液的体积无关.
解答 解:50mL 1mol•L-1AlCl3溶液中氯离子的物质的量浓度为:1mol•L-1×3=3mol•L-1,
A、150mL3mol•L-1的NaClO3溶液,因中NaClO3电离产生Na+和ClO3-,无Cl-,所以Cl-浓度为0,和AlCl3溶液中Cl-浓度3mol/L不相等,故A错误;
B、75mL3mol•L-1CaCl2溶液溶液中Cl-浓度是3mol•L-1×2=6mol•L-1,和AlCl3溶液中Cl-浓度3mol/L不相等,故B错误;
C、150mL3mol•L-1的KCl溶液中Cl-浓度是3mol•L-1×1=3mol•L-1,和AlCl3溶液中Cl-浓度3mol/L相等,故C正确;
D、50mL3mol•L-1MgCl2溶液中Cl-浓度是3mol•L-1×2=6mol•L-1,和AlCl3溶液中Cl-浓度3mol/L不相等,故D错误;
故选C.
点评 本题是一道关于离子浓度的计算题,注意电离知识的灵活应用,可以根据所学知识进行回答,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 s | B. | 2 s | C. | 44 s | D. | 1.33 s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32.0% | B. | 22.0% | C. | 45.0% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学在学习酸碱指示剂与常见酸、碱溶液作用时,归纳成如图所示的关系.图中A、B、C、D分别表示指示剂与酸、碱溶液作用时所显示出的颜色,其中不正确的是( )
某同学在学习酸碱指示剂与常见酸、碱溶液作用时,归纳成如图所示的关系.图中A、B、C、D分别表示指示剂与酸、碱溶液作用时所显示出的颜色,其中不正确的是( )| A. | 紫色 | B. | 蓝色 | C. | 红色 | D. | 无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
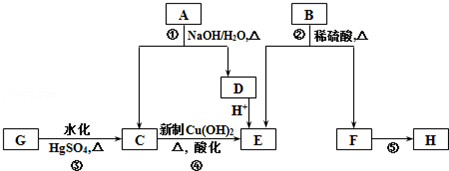
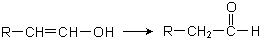
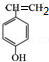
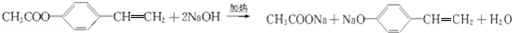 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
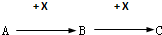
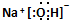 .
.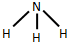 ,写出A生成B的反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,写出A生成B的反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com