
【题目】下列有关化学基本概念的说法不正确的是
A.乙醇和二甲醚互为同分异构体
B.碳、硫、磷均存在同素异形现象
C.氢元素存在 1H、2H、3H 三种核素,它们互为同位素
D.O2 转变成 O3 属于物理变化
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂恰好变色,且30分钟不变化,测得所耗盐酸的体积为V1mL;
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)锥形瓶中的溶液从色变为色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察;
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 , 由此造成的测定结果(填偏高、偏低或无影响);
(4)步骤②缺少的操作是;
(5)如图,是某次滴定时的滴定管中的液面,其读数为mL;
(6)根据如表数据:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
请计算待测烧碱溶液的浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是( )
A.灼热的碳与CO2的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.铝片与稀盐酸的反应
D.甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关硅元素的下列叙述中正确的是( )
A.硅、碳与氢氟酸都不反应
B.硅是构成矿物岩石的主要原料,其化合态硅几乎全部是硅石和硅酸盐
C.硅与碳性质都很稳定,都能以游离态存在于自然界
D.晶体硅、石墨都可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、技术、环境、生活密切相关,下列有关说法中错误的是
A.处理秸秆的方法之一,是将秸秆转化为乙醇以作汽车燃料
B.在过渡元素中可以寻找到优良的催化剂
C.为卫星供电的太阳能帆板主要由二氧化硅制成
D.镧镍合金等贮氢合金的发现和应用解决了氢气贮存、运输等难题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示在某溶液中滴加Ba(OH)2 溶液时,沉淀的物质的量随Ba(OH)2 的物质的量的变化关系。该溶液的成分可能是
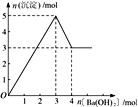
A. MgSO4 B. Al2 (SO4 )3 C. Fe2 (SO4 )3 D. NaAlO2
【答案】B
【解析】A、氢氧化镁不溶于氢氧化钡溶液,沉淀量达最大后,再加氢氧化钡溶液,沉淀量不变,A错误;B、由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH-===AlO2-+2H2O可知沉淀中Al(OH)3为2mol,故Al2(SO4)3为1mol,加入3mol氢氧化钡,可以生成硫酸钡3mol,n(Al3+):n(OH-)=2mol:6mol=1:3,发生反应Al3++3OH-===Al(OH)3↓,可以得到2molAl(OH)3,沉淀为3mol+2mol=5mol,B正确;C、硫酸铁与氢氧化钡溶液反应生成氢氧化铁,氢氧化铁不溶于氢氧化钡,则沉淀量达最大后,再加氢氧化钡溶液,沉淀的量不变,与图象不一致,C错误;D、偏铝酸钠与氢氧化钡不反应,不能产生沉淀,D错误;答案选B。
点睛:本题以图象为载体考查镁铝化合物的性质,明确发生的化学反应是解答的关键,反应发生的先后顺序是学生解答中的难点,注意图象比例关系,注意氢氧化铝两性特点。
【题型】单选题
【结束】
15
【题目】如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时沉淀的物质的量y mol与加入NaOH溶液和盐酸的体积x mL的关系图,根据图示判断,下列结论中不正确的是
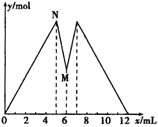
A. N点时溶液中的溶质只有NaCl
B. 原混合溶液中c (MgCl2)∶c (AlCl3)=1∶2
C. c (NaOH)=c (HCl)
D. M点之前加入的是NaOH溶液,M点之后加入的是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能达到实验目的的是 ( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | 铜 | 溴水 | 验证浓硫酸具有强氧化性 | |
B | 浓盐酸 | 浓硫酸 | 空气 | 制取并收集HCl | |
C | 浓氨水 | 氧化钙 | 空气 | 制取并收集NH3 | |
D | 稀硫酸 | Na2CO3 | Na2SiO3 溶液 | 验证酸性:硫酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)无水氯化铝在生产、生活中应用广泛。
①氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为__________。
② 已知:Al2O3(s)+3C(s)2Al(s)+3CO(g) ΔH1= + 1344.1 kJ·mol-1
2AlCl3(g)2Al(s)+3Cl2(g) ΔH2= + 1169.2 kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为________________________。
(2)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。

①该电化腐蚀称为 _________________。
②图中A、B、C、D四个区域,生成铁锈最多的是 ____(填字母)。
(3)酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可以得到多种化工原料。
①该电池的负极反应式为 _______________;
②该电池的正极反应式为 _______________;
③电池反应的离子方程式为 ______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍
C.室温下,pH=3的亚硫酸溶液中的氢离子浓度与pH=11的氨水中的氢氧根离子浓度相等
D.室温时,将pH=5的H2SO4溶液稀释1000倍,则c(H+):c (SO42﹣)=2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com