
【题目】咖啡酸(如图),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,特别对内脏的止血效果较好。

(1)咖啡酸的分子式是___,其中含氧官能团的名称为___、___。
(2)咖啡酸可以发生的反应是___(填写序号)。
①水解反应 ②加成反应 ③酯化反应 ④中和反应
(3)1mol咖啡酸与浓溴水反应时最多消耗___molBr2。
(4)咖啡酸与NaHCO3溶液反应的方程式___。
(5)蜂胶的主要活性成分为CPAE,分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇且分子结构中无甲基,此芳香醇的结构简式为___。
【答案】C9H8O4 羧基 酚羟基 ②③④ 4mol 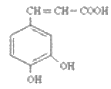 +NaHCO3
+NaHCO3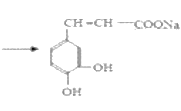 +CO2↑+H2O
+CO2↑+H2O 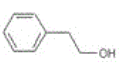
【解析】
根据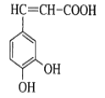 是咖啡酸的结构式,可得出它的分子式C9H8O4 ,官能团决定了有机物的化学性质,咖啡酸的官能团有羟基,羧基,碳碳双键,其中含氧的官能团有羧基、羟基(酚羟基),根据官能团可知,该物质可以发生加成反应,氧化反应,酯化反应。发生加成反应时,消耗1mol溴,苯环上的三个氢原子也可以与溴发生取代反应,1mol羧基消耗1molNaHCO3,反应生成钠盐,水和二氧化碳。C17H16O4在一定条件下可水解生成咖啡酸和一种醇 , 咖啡酸的分子式为C9H8O4 ,说明这种物质属于酯,分子式为C8H10O,该醇为芳香醇且分子结构中无甲基,说明分子中要有苯环,羟基,羟基不与苯环直接相连,故得到该物质的结构式
是咖啡酸的结构式,可得出它的分子式C9H8O4 ,官能团决定了有机物的化学性质,咖啡酸的官能团有羟基,羧基,碳碳双键,其中含氧的官能团有羧基、羟基(酚羟基),根据官能团可知,该物质可以发生加成反应,氧化反应,酯化反应。发生加成反应时,消耗1mol溴,苯环上的三个氢原子也可以与溴发生取代反应,1mol羧基消耗1molNaHCO3,反应生成钠盐,水和二氧化碳。C17H16O4在一定条件下可水解生成咖啡酸和一种醇 , 咖啡酸的分子式为C9H8O4 ,说明这种物质属于酯,分子式为C8H10O,该醇为芳香醇且分子结构中无甲基,说明分子中要有苯环,羟基,羟基不与苯环直接相连,故得到该物质的结构式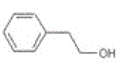
(1)由![]() 可知,含氧官能团为羧基、羟基(酚羟基),
可知,含氧官能团为羧基、羟基(酚羟基),
故答案为:羧基、羟基(酚羟基);
(2)含有碳碳双键,可发生加成反应,含有羧基,可发生酯化反应,不能发生水解、消去反应,故答案为:②③;
(3)碳碳双键可发生加成反应,酚羟基邻位、对位氢原子可被溴取代,则1mol咖啡酸与浓溴水反应时最多消耗4mol Br2,
故答案为:4;
(4)只有羧基与NaHCO3溶液反应,反应的方程式为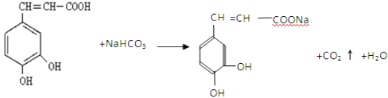 ,
,
故答案为: ;
;
(5)蜂胶的主要活性成分为CPAE,分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇且分子结构中无甲基,此芳香醇的结构简式为
 可与
可与![]() 发生酯化反应,
发生酯化反应,
故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗高磷酸盐血症。某化学小组用如图装置模拟制备碳酸镧,反应为2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O下列说法正确的是
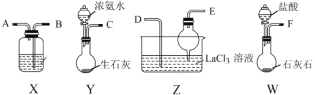
A.从左向右接口的连接顺序:F→B,A→D,E←C
B.装置X中盛放的试剂为饱和Na2CO3溶液
C.实验开始时应先打开W中分液漏斗的旋转活塞
D.装置Z中用干燥管的主要目的是增大接触面积,加快气体溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。查阅资料:
平衡Ⅰ:![]()
平衡Ⅱ:![]()
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/mgL-1 | 72 | ≤0.5 |
NH4+/mgL-1 | 2632 | ≤15 |
下列说法错误的是( )
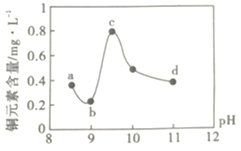
A.a~b段发生的反应为:![]()
B.b~c段:随pH升高,Cu(OH)2的量增加,导致平衡Ⅰ正向移动,铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡Ⅰ逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物说法不正确的是( )
A.对甲基苯乙烯中最多有17个原子共面
B.萘环(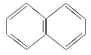 )上的一个H原子被-C4H9取代后的产物只有2种
)上的一个H原子被-C4H9取代后的产物只有2种
C.BrCH2CHBrCH2Br的名称为三溴丙烷
D.立方烷(![]() )一氯代物1种、二氯代物有3种
)一氯代物1种、二氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pK=-lgK,25℃时,二元酸H2A的pK1=1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是

A. a点所得溶液中:Vo=10mL
B. C点所得溶液中:c(A2-)=c(HA-)
C. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨与水相似,存在着微弱的电离:2NH3![]()
![]() +
+![]() 。-50℃时,两种离子的平衡浓度均为1×10-15mol/L,下列有关液氨的离子积及其电离平衡的叙述中错误的是
。-50℃时,两种离子的平衡浓度均为1×10-15mol/L,下列有关液氨的离子积及其电离平衡的叙述中错误的是
A.此温度下,液氨的离子积等于1×10-30
B.在液氨中放入NaNH2,则液氨的离子积数值将增大
C.此温度下,在液氨中加入NaNH2,则液氨中c(![]() )<1×10-15mol/L
)<1×10-15mol/L
D.在液氨中加入NH4Cl,则液氨中c(![]() )将大于c(
)将大于c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g)![]() xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示,下列说法不正确的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示,下列说法不正确的是
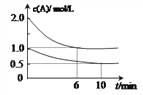
A. x=1
B. 此条件下,该反应的平衡常数K=4
C. 给乙容器升温可缩短反应达平衡的时间但不能提高平衡转化率
D. 甲和乙中B的平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国芝加哥大学化学研究所近日揭示了WO3/CeO2-TiO2双催化剂在低温下催化氮的污染性气体转化为无毒气体,其过程如图所示
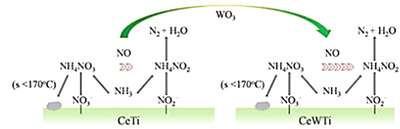
(1)Ti价电子排布式为______________,其能量最高的能层是___________。
(2)N、O、H三种原子的电负性由大到小的顺序为___________________。
(3)NO2-的空间构型为___________,与NO3-互为等电子体的分子为_______________
(4)WO3可作为苯乙烯氧化的催化剂![]() +H2O2
+H2O2![]()
![]() +H2O
+H2O
①![]() 中碳原子的杂化方式为_________。
中碳原子的杂化方式为_________。
②1molH2O2中δ键个数为____________。
③![]() 属于______________晶体。
属于______________晶体。
(5)W和Ti可形成金属互化物,某W和Ti的金属互化物如图所示,则该晶体的化学式为__________。
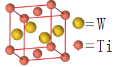
(6)金属钛的晶体堆积方式为 ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将0.04mol·L-1的某酸(A)溶液和0.02mol·L-1NaOH溶液等体积混合得混合溶液Q。
(1)若A为CH3COOH,Q呈酸性,溶液中所有离子按浓度由大到小排列的顺序是___;若A为HCl,100℃时(Kw=10-12),溶液中由水电离出的H+浓度为___mol·L-1;若A为H2S,Q接近中性,则HS-的电离能力___水解能力(填“>”“<”“=”或“无法确定”)。
(2)根据(1)中信息比较相同条件下,浓度均为0.01mol·L-1的①NaHS、②CH3COONa、③NaCl溶液中,阴离子总浓度由大到小的顺序为___(填序号)。
(3)用浓度为0.01mol·L-1的NaOH溶液滴定相同体积、相同浓度的①HCl溶液、②CH3COOH溶液、③H2S溶液,当滴定至中性时,消耗NaOH溶液的体积分别为amL、bmL、cmL,则a、b、c的大小关系是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com