
【题目】苯甲酸甲酯是重要的化工原料,某化学兴趣小组仿照实验室制乙酸乙酯的原理以苯甲酸(C6H5COOH)和甲醇为原料制备苯甲酸甲酯。有关数据如下:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度(g/cm3) | 水溶性 | |
苯甲酸 | 122 | 122.4 | 249 | 1.2659 | 微溶 |
甲醇 | 32 | -97 | 64.6 | 0.792 | 互溶 |
苯甲酸甲酯 | 136 | -12.3 | 196.6 | 1.0888 | 不溶 |
I.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,在圆底烧瓶上连接冷凝回流装置后,小心加热2小时,得苯甲酸甲酯粗产品。
回答下列问题:
(1)该反应的化学方程式为__________,该反应的原子利用率是_______。
己知:原子利用率=(预期产物的总质量/全部反应物的总质量)×100%
(2)实验中,应选择(如下图)_____(填序号)作为冷凝回流装置,该仪器的名称为______。

(3)使用过量甲醇的原因是__________。
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制。

(4)饱和碳酸钠溶液的作用是________,操作a的名称为________。
(5)由于有机层和水层的密度比较接近,兴趣小组的同学无法直接判断有机层在上层还是下层,请你设计简单易行的方案,简述实验方法,可能的现象及结论__________。
(6)该实验中制得苯甲酸甲酯8.30g,则苯甲酸甲酯的产率为________。
【答案】 C6H5COOH+CH3OH![]() C6H5COOCH3+H2O 88.3% B 球形冷凝管 由于甲醇沸点低,易挥发,损失大,还为了提高苯甲酸的利用率,故应使用过量甲醇 饱和碳酸钠溶液能与苯甲酸反应,生成可溶性的苯甲酸钠,还能溶解甲醇,降低苯甲酸甲酯的溶解度 分液 向混合液中加少量水,振荡、静置,体积增加的为水层,体积不变的为有机层,或者从分液漏斗下口放出少量液体,置于试管中,加适量水,振荡、静置,若液体分层,则有机层在下层,若液体不分层,则有机层在上层 61.0%
C6H5COOCH3+H2O 88.3% B 球形冷凝管 由于甲醇沸点低,易挥发,损失大,还为了提高苯甲酸的利用率,故应使用过量甲醇 饱和碳酸钠溶液能与苯甲酸反应,生成可溶性的苯甲酸钠,还能溶解甲醇,降低苯甲酸甲酯的溶解度 分液 向混合液中加少量水,振荡、静置,体积增加的为水层,体积不变的为有机层,或者从分液漏斗下口放出少量液体,置于试管中,加适量水,振荡、静置,若液体分层,则有机层在下层,若液体不分层,则有机层在上层 61.0%
【解析】I. (1)苯甲酸与甲醇发生酯化反应生成苯甲酸甲酯,反应的化学方程式为C6H5COOH+CH3OH![]() C6H5COOCH3+H2O,该反应的原子利用率=
C6H5COOCH3+H2O,该反应的原子利用率=![]() ×100%=88.3%,故答案为:C6H5COOH+CH3OH
×100%=88.3%,故答案为:C6H5COOH+CH3OH![]() C6H5COOCH3+H2O;88.3%;
C6H5COOCH3+H2O;88.3%;
(2)根据图中的数据可知,甲醇的沸点较低,易挥发,球形冷凝管冷却效果比直形冷凝管好,所以用球形冷凝管,选B,故答案为:B;球形冷凝管;
(3)甲醇沸点低,损失大;甲醇过量可以提高苯甲酸的利用率,所以在反应中要使用过量的甲醇,以提高反应的产率,故答案为:甲醇沸点低,损失大;甲醇过量可以提高苯甲酸的利用率;
Ⅱ.(4)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,甲醇溶于水,苯甲酸与碳酸钠反应,同时苯甲酸甲酯在碳酸钠中的溶解度小,可以提纯苯甲酸甲酯,苯甲酸甲酯不溶于水,分离两种不互溶的液体用分液的方法,所以碳酸钠的作用是除去苯甲酸甲酯中的杂质苯甲酸,溶解甲醇,降低苯甲酸甲酯溶解度,操作a为分液,故答案为:除去苯甲酸甲酯中的杂质苯甲酸,溶解甲醇,降低苯甲酸甲酯溶解度;分液;
(5)向混合液中加少量水,振荡、静置,体积增加的为水层,体积不变的为有机层,或者从分液漏斗下口放出少量液体,置于试管中,加适量水,振荡、静置,若液体分层,则有机层在下层,若液体不分层,则有机层在上层,故答案为:向混合液中加少量水,振荡、静置,体积增加的为水层,体积不变的为有机层,或者从分液漏斗下口放出少量液体,置于试管中,加适量水,振荡、静置,若液体分层,则有机层在下层,若液体不分层,则有机层在上层;
(6)12.2g苯甲酸的物质的量为: ![]() =0.1mol,20mL甲醇(密度约0.79g/mL)的物质的量为:
=0.1mol,20mL甲醇(密度约0.79g/mL)的物质的量为: ![]() =0.49mol>0.1mol,则理论上生成苯甲酸甲酯的物质的量为:0.1mol,质量为:136g/mol×0.1mol=13.6g,则苯甲酸甲酯的产率为:
=0.49mol>0.1mol,则理论上生成苯甲酸甲酯的物质的量为:0.1mol,质量为:136g/mol×0.1mol=13.6g,则苯甲酸甲酯的产率为: ![]() ×100%=61.0%,故答案为:61.0%。
×100%=61.0%,故答案为:61.0%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有机合成路线流程图示例如下:![]()
按要求写出下列合成的线流程图(无机试剂任选)
(1)以为原料![]() ,合成
,合成![]() :_________ 。
:_________ 。
(2)一卤代烃R-X与金属钠作用,可以增加碳链,反应的化学方程式为:R-X+2Na+X-R*![]() R-R*+2NaX,R,R*为烃基,可相同,也可不相同,X为卤原子,试以苯、乙炔、Br2、HBr、钠为主要原料,通过三步反应合成
R-R*+2NaX,R,R*为烃基,可相同,也可不相同,X为卤原子,试以苯、乙炔、Br2、HBr、钠为主要原料,通过三步反应合成![]() 。
。
______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些科学家提出硅是“21世纪的能源”,下列关于硅及其化合物的说法正确的是
A. SiO2是一种酸性氧化物,所以不和任何酸反应
B. 高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应
C. 光导纤维的主要成分是SiO2
D. 自然界中硅元素的储量丰富,主要以硅单质的形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内分别装有滴有不同溶液的白色棉球,反应一段时间后,对图中指定部分颜色描述正确的是( )
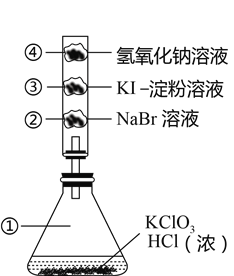
选项 | ① | ② | ③ | ④ |
A | 黄绿色 | 白色 | 紫色 | 白色 |
B | 黄绿色 | 橙色 | 紫色 | 黄绿色 |
C | 黄绿色 | 橙色 | 蓝色 | 白色 |
D | 黄绿色 | 橙色 | 蓝色 | 黄绿色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类历史上,硅及其化合物的应用由来已久。请回答下列问题。
(1)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

已知:反应②的反应为Si+3HCl![]() SiHCl3+H2
SiHCl3+H2
上述反应①-④中,属于置换反应的是______________________________;反应③中发生主要反应的化学方程式为_____________________________________;该工艺中可循环使用的物质为______________________________(填化学式)。
(2)用石英砂和焦炭在电弧炉中高温加热也可以得到无机材料碳化硅。请写出制备碳化硅反应的化学方程式为________________________________________;碳化硅属于晶体___________。(填晶体类型)
(3)氮化硅是一种耐高温材料,粉末状氮化硅可以由SiCl4的蒸气和NH3反应制取。请问:
①氮化硅的化学式为______________________________。
②由SiCl4和NH3反应制取氮化硅的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是
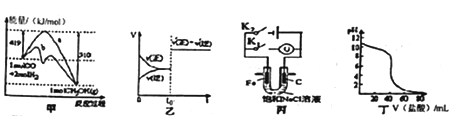
A. 图甲表示工业上用CO生产甲醇的反应CO(g)+2H2(g) ![]() CH3OH(g)。该反应的 △H=-91 kJ·mol-1
CH3OH(g)。该反应的 △H=-91 kJ·mol-1
B. 图乙表示己达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改 变的条件可能处加入催化剂
C. 图丙中若K1闭合,石墨棒周围液pH逐渐升高;若K2闭合,电路中通过0.002NA 个电子时,两极理论上共产生0.002mol气体
D. 图丁表示盐酸滴加0.1 mol·L-1NaOH溶液得到的滴定曲线,该实验的指示剂最好选取酚酞
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com