
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
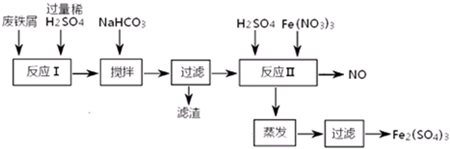
分析 由流程可知,Fe、Al和稀硫酸反应生成FeSO4、Al2(SO4)3和氢气,向混合溶液中加入NaHCO3,调节溶液的pH,根据沉淀物与pH的关系知,要是铝离子产生沉淀,则pH应该在4.4-7.5之间,然后过滤得到滤液,向滤液中加入稀硫酸、硝酸铁,酸性条件下,亚铁离子被氧化生成铁离子,同时生成NO,然后采用蒸发浓缩、冷却结晶、过滤得到Fe2(SO4)3,以此来解答.
解答 解:由流程可知,Fe、Al和稀硫酸反应生成FeSO4、Al2(SO4)3和氢气,向混合溶液中加入NaHCO3,调节溶液的pH,根据沉淀物与pH的关系知,要是铝离子产生沉淀,则pH应该在4.4-7.5之间,然后过滤得到滤液,向滤液中加入稀硫酸、硝酸铁,酸性条件下,亚铁离子被氧化生成铁离子,同时生成NO,然后采用蒸发浓缩、冷却结晶、过滤得到Fe2(SO4)3,
①加NaHCO3时,混合液pH值应控制在Al(OH)3完全沉淀、Fe(OH)2不产生沉淀,根据沉淀物与pH的关系知,要是铝离子产生沉淀,则pH应该在4.4-7.5之间,
故答案为:4.4~7.5
②酸性条件下,硝酸根离子和亚铁离子发生氧化还原反应,离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
③反应Ⅱ中需要强氧化性的酸将二价铁离子氧化,一氧化氮有毒,但一氧化氮易与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,总的反应为4NO+3O2+2H2O=4HNO3,将O2和反应Ⅱ产生的NO,按3:4配比混合后重新通入反应Ⅱ中,可节约Fe(NO3)3、防止NO污染,
故答案为:节约Fe(NO3)3、防止NO污染;3:4.
点评 本题考查物质的制备实验,为高频考点,把握流程中的反应及混合物分离为解答本题的关键,注意酸性条件下硝酸根离子具有强氧化性,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 转移电子4.8NA个 | B. | 生成气体的体积42.56L(标准状况) | ||
| C. | 还原剂比氧化剂多0.2mol | D. | 被还原的氮原子是11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.05NA个CO2分子所占的体积是1.12L | |
| B. | 1mol 氧气所含有的原子数为NA | |
| C. | 常温常压下,32g O2和34g H2S气体分子个数比为1:1 | |
| D. | 11.2L NH3中所含的质子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成次氯酸具有漂白性 |
| 然后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象和结论 |
步骤1:取少量沉淀于试管中,加入足量0.1 mol•L-1 HCl . | 沉淀全部溶解,有气泡产生,说明沉淀中有CaCO3 |
步骤2:往步骤1的剩余物中,再滴加几滴0.01 mol•L-1 KMnO4 . | 溶液紫红色褪去,说明沉淀中有CaC2O4,结合步骤1,假设2成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 3mol | C. | 4mol | D. | 6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知铅蓄电池的总反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )
已知铅蓄电池的总反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )| A. | 铅蓄电池放电时,电路中每转移2mol电子,生成1mol硫酸铅 | |
| B. | 如图,铁铆钉发生吸氧腐蚀,在铁钉附近滴加K3[Fe(CN)6]溶液,可观察铁钉附近有蓝色沉淀产生 | |
| C. | 铅蓄电池充电时,阳极电极反应为 PbSO4+2H2O-2e-═PbO2+4H++SO42- | |
| D. | 铅蓄电池放电时,内电路硫酸根离子向铅极移动,正极附近溶液的pH增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com