
【题目】用如图所示装置进行实验,将A逐滴加入B中。
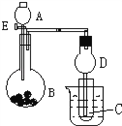
a.若B为Na2CO3粉末,C为C6H5ONa溶液,实验中观察到小试管内溶液由澄清变浑浊,则试管C中化学反应的离子方程式__________;然后往烧杯中加入沸水,可观察到试管C中的现象_______;
b.若B是生石灰,观察到C溶液中先形成沉淀,然后沉淀溶解.当沉淀完全溶解,恰好变澄清时,关闭E.然后往小试管中加入3滴乙醛,再往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是_____________(填名称),C是_______(填化学式).与乙醛溶液混合后,该溶液中反应的化学方程式________;仪器D在此实验中的作用是______。
【答案】 C6H5O﹣+H2O+CO2=C6H5OH+HCO3﹣ 浑浊变澄清 氨水 AgNO3 CH3CHO+2[Ag(NH3)2]OH![]() CH3COONH4+2Ag↓+3NH3+H2O 防止倒吸
CH3COONH4+2Ag↓+3NH3+H2O 防止倒吸
【解析】试题分析:a.若B为Na2CO3粉末,C为C6H5ONa溶液,实验中观察到小试管内溶液由澄清变浑浊,说明有苯酚生成。由此可推断,A可能为稀硫酸,与碳酸钠反应后生成了二氧化碳,二氧化碳通入苯酚钠溶液后与其反应生成了苯酚,苯酚常温下在水中的溶解度很小,所以得到浊液,试管C中发生反应的离子方程式为C6H5O﹣+H2O+CO2=C6H5OH+HCO3﹣;然后往烧杯中加入沸水,因为苯酚在65℃以上可以与水以任意比互溶,所以可观察到试管C中的现象浑浊变澄清;b.若B是生石灰,观察到C溶液中先形成沉淀,然后沉淀溶解.当沉淀完全溶解,恰好变澄清时,关闭E.然后往小试管中加入3滴乙醛,再往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,说明发生了银镜反应,则A是氨水,氨水与生石灰作用生成氨气(生石灰与水反应放出大量的热促使一水合氨分解生成氨气),C是硝酸银溶液(化学式为AgNO3),氨气通入硝酸银溶液先生成氢氧化银沉淀,然后沉淀又溶于氨水得到银氨溶液,与乙醛溶液混合后加热,发生了银镜反应,该溶液中反应的化学方程式CH3CHO+2[Ag(NH3)2]OH![]() CH3COONH4+2Ag↓+3NH3+H2O;氨气极易溶于水,所以仪器D在此实验中的作用是防止倒吸。
CH3COONH4+2Ag↓+3NH3+H2O;氨气极易溶于水,所以仪器D在此实验中的作用是防止倒吸。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】黄铜矿不仅可用于火法炼铜,也可用于湿法炼铜,湿法可同时生产铜、磁性氧化铁和用于橡胶工业的一种固体物质A,流程如下:
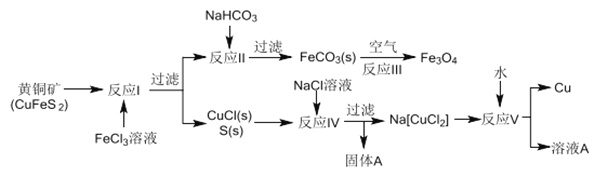
(1)黄铜矿中Cu 的化合价是______,反应I中65gFeC13 可氧化________mol CuFeS2。
(2)工业生产中的过滤操作多采用倾析法分离出固体物质,下列适合用倾析法的有______。
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)在反应Ⅱ中,计算NaHCO3饱和溶液(其中CO32-平衡浓度为1.2×10-3mol/L)可产生FeCO3沉淀时的最小Fe2+浓度是_________(己知FeCO3的Ksp=3.0×10-11)
(4)反应Ⅲ是在设备底部鼓入空气,高温氧化锻烧法来制备磁性氧化铁,写出对应的化学方程式_________________。
(5)固体物质A的成分________(写名称)。
(6)潮湿的FeCO3固体若不及时灼烧处理会在空气中逐渐变红,写出相关的化学方程式:_______________。
(7)本流程中可实现循环使用的物质除了水外,还有_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于在恒容密闭容器中进行的反应:2SO2(g) +O2(g)2SO3(g), 下列叙述能充分说明该反应已经达到化学平衡状态的是( )
A.正、逆反应速率都等于零B.SO2、O2、SO3的浓度相等
C.SO2、O2、SO3在容器中共存D.SO2、O2、SO3的浓度均不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把400 mL NH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含a mol NaOH的溶液恰好反应完全;取另一份加入含b mol HCl的溶液恰好反应完全。该混合溶液中c(Na+)为( )
A. (10b-5a) mol·L-1 B. (b-0.5a) mol·L-1
C. (![]() -
-![]() ) mol·L-1 D. (5b-
) mol·L-1 D. (5b-![]() ) mol·L-1
) mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有100mL含Cu2+、Al3+、NH4+、H+、Cl-的溶液,向该溶液中逐滴加入2.5mol·L-1NaOH溶液,所加NaOH 溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示:

(1)B点的沉淀物的化学式为______________。
(2)原溶液中Cu2+的物质的量为______,原溶液中Cl-物质的量浓度为__________。
(3)原溶液的pH=__________,x-y= _________。
(4)经过滤得到D点的沉淀物,并多次用蒸馏水洗涤沉淀,判断沉淀是否洗涤干净的方法是_________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下。
2P(s)+3Cl2(g)=2PCl3(g) ΔH=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g) ΔH=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为________.
(2)不同温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
则ΔH1______0(填“<”“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mol/L,则CO的平衡转化率为______。
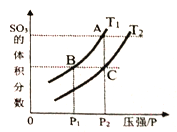
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
A.SO2和SO3浓度相等
B.容器中混合气体的密度保持不变
C.容器中气体的温度保持不变
D.SO3的生成速率与SO2的消耗速率相等
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1____T2 (填“>”或“<");理由是_____。如果想加快正反应的速率,除了改变温度,还可以用_______方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),其过程如下:
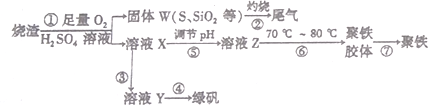
(1)过程③中,需要加入的物质名称是____________________。
(2)过程②中产生的尾气会对大气造成污染,可选用下列试剂中的___________吸收。
a.浓硫酸 b.蒸馏水 c.NaOH溶液 d.浓硝酸
(3)过程①中,FeS和O2、H2SO4反应的化学方程式为____________________。
(4)过程④的实验操作是____________________。
(5)过程⑥中,将溶液Z加热到70℃~80℃,目的是 ___________________。
(6)某种脱硫脱硝工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设废气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为__________________。
(7)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取样品2.700 g;②将样品溶于足量盐酸后,加入足量的氯化钡溶液:③过滤、洗涤、干燥、称量,得固体质量为3.495g,若该聚铁主要成分为[Fe(OH)SO4]a,则该聚铁中铁元素的质量分数为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com