
【题目】化学与生活密切相关。下列叙述错误的是
A.SO2可用于漂白纸浆B.SiO2可用于制光导纤维
C.NaClO溶液可用于杀菌消毒D.Cu(OH) 2可用作口服制酸剂
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置进行铜的电解精炼实验(粗铜中有锌、铁、镍、银等杂质,部分导线未画出),下列说法正确的是( )

A. a应与c相连接,b应与d相连接
B. 电解一段时间,b与d两极析出物质的物质的量相等
C. 电解后Fe、Zn、Ag等杂质会沉积在装置Y的底部形成阳极泥
D. 电解过程中,Y装置中Cu2+的浓度始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200mL 0.3molL﹣1的K2SO4溶液和100mL 0.2molL﹣1的Fe2(SO4)3溶液混合后,若忽略液体混合时体积的变化,则溶液中SO ![]() 的物质的量浓度为( )
的物质的量浓度为( )
A.0.3 molL﹣1
B.0.4 molL﹣1
C.0.45 molL﹣1
D.0.5 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发射卫星的火箭推进器中大多使用燃料偏二甲肼,其化学式C2H8N2 . 计算:
(1)偏二甲肼的摩尔质量是;480g偏二甲肼的物质的量为 .
(2)偏二甲肼中碳原子与氮原子的个数之比是 , 其物质的量之比是;1mol偏二甲肼中含有的氢原子数目是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)N位于周期表中第 周期 族,与N3-含有相同电子数的三原子分子的空间构型是 。
(2)C、N、O三种元素的第一电离能由大到小的顺序为
(3)Cu+电子排布式为 ,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu20,试从结构角度解释高温下CuO何会生成Cu2O: 。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是 ,乙醛分子中H—C—O的键角 (填“大于”“等于”或“小于”)乙醇分子中的H—C一0的键角。
(5)[Cu(H20)4]2+为平面正方形结构,其中的两个H20被Cl-取代有两种不同的结构,试画出[Cu(H20)2(C1)2]具有极性的分子的结构式: 。
(6)Cu3N的晶胞结构如图,N3-的配位数为 ,Cu+半径为a pm,N3- 半径为b pm,Cu3N的密度为 g·cm-3。(阿伏加德罗常数用NA表示)
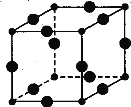
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在工农业生产中有重要作用。
(1)氨和N2H4是两种常见的氮氢化合物。已知:
4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)△H1=-541.8kJ·mol-1
2N2(g)+6H2O(g)△H1=-541.8kJ·mol-1
N2H4(g)+O2(g)![]() N2(g)+2H2O(g)△H2=-534kJ·mol-1
N2(g)+2H2O(g)△H2=-534kJ·mol-1
则NH3(g)和O2(g)制取N2H4(g)的热化学方程式为_______________
(2)二氧化氮在一定条件下能发生如下反应:
NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=-42kJ·mol-1
SO3(g)+NO(g) △H=-42kJ·mol-1
在体积为2L的恒容密闭容器中充入SO2(g)和NO2(g),实验所得数据如下:
实验编号 | 温度 | 起始物质的量/mol | 平衡时物质的量/mol | |
n(SO2) | n(NO2) | n(NO) | ||
甲 | T1 | 4 | 2 | 0.8 |
乙 | T2 | 2 | 4 | 0.6 |
丙 | T1 | 2 | 1 | a |
①在实验甲中,若2min时测得放出的热量是8.4kJ,该温度下的平衡常数为_______(保留到小数点后两位)
②由表中数据可推知T1_____T2(填“﹥“<”或“=”)
③实验丙中,达到平衡时NO2的转化率为_______
(3)使用间接电化学法可以处理煤烟气中的NO,反应原理如下图所示,已知电解池溶液的pH在4-7之间,写出阴极的电极反应式____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.28g氮气所含有的原子数目为NA
B.在常温常压下,11.2L N2含有的分子数为0.5NA
C.0.5mol单质铝与足量盐酸反应转移电子数为1.5NA
D.标准状况下,1L水所含分子数为1/22.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】列式计算:
(1)将标准状况下的HCl气体336L溶于1.0L水中,所得盐酸密度为1.2gcm﹣3 , 求该盐酸物质的量浓度.(保留三位有效数字)
(2)欲使100g 10.4%的NaOH溶液溶质的质量分数增大到20%; ①需往溶液中加入多少克氢氧化钠?
②若20%NaOH溶液的密度为1.066g/cm3 , 计算物质的量浓度.(保留小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石(主要成分为 CuCO3·Cu(OH)2、CuSiO3·2H2O,含 SiO2、FeCO3、 Fe2O3等杂质)为原料制备CuCl2的工艺流程如下:

已知:SOCl2+H2O![]() SO2↑+2HCl↑
SO2↑+2HCl↑
(1)“酸浸”时盐酸与CuCO3Cu(OH)2反应的化学方程式为____。为提高“酸浸”时铜元素的浸出率,可以采取的措施有:①适当加快搅拌速率;②______________。(任答一点即可)
(2)“氧化”时发生反应的离子方程式为__________。
(3)“滤渣1”的主要成分为SiO2和H2SiO3等,“滤渣2”的主要成分为______________(填化学式);试剂X可选择_____(填字母)。
a. Cu b. NaOH c. Cu(OH)2 d.氨水
(4)“调pH”时,pH不能过高,其原因是_________________________。
(5)“加热脱水”时,加入SOCl2的目的是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com