
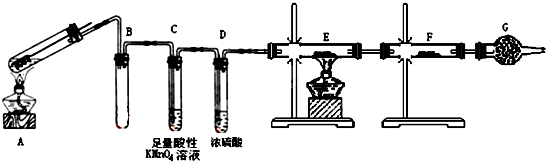
分析 由图可知,A中发生Fe与浓硫酸的反应生成SO2还可能生成氢气,B中均为短导管可防止倒吸,C中高锰酸钾褪色可检验SO2,D干燥气体,E中发生CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,F中无水硫酸铜可检验E中的氧化产物,G为干燥管,G可防止空气中的水进入F中干扰E中氧化产物的检验,以此分析(1)~(3);
(4)检验其中的Fe2+,利用其还原性;
(5)因为浓硫酸中的水很少,而且浓硫酸具有吸水性;将浓硫酸倒出,在固体中加水看溶液是否变蓝色判断CuSO4生成.
解答 解:(1)熄灭A装置中酒精灯时,A装置中气体冷却压强减小,C装置中溶液易进入A试管中产生倒吸现象,所以B装置的作用是防止倒吸;酸性高锰酸钾溶液有强氧化性,二氧化硫能和酸性高锰酸钾溶液发生氧化还原反应而使其褪色,所以酸性高锰酸钾的作用是:验证有SO2生成,同时除去SO2;空气中含有水蒸气,如果没有G装置,水蒸气进入F装置干扰实验,所以G的作用是:防止空气中的H2O进入F,
故答案为:防止倒吸;验证有SO2生成,同时除去SO2;防止空气中的H2O进入F;
(2)二氧化硫有还原性,酸性高锰酸钾有强氧化性,二者能发生氧化还原反应而使酸性高锰酸钾溶液颜色变浅,
故答案为:酸性高锰酸钾溶液颜色变浅;
(3)生成的气体经洗气和干燥后剩余的气体就是氢气,氢气有还原性能和氧化铜在加热条件下发生置换反应生成铜单质,生成的水遇无水硫酸铜时白色固体变蓝色,所以证明含有氢气的现象是:E中黑色(CuO)变成红色(Cu),F中白色粉末变成蓝色;制取的气体中含有水蒸气,如果去掉D装置,会干扰H2的检验,所以不能,
故答案为:黑色(CuO)变成红色(Cu);白色粉末变成蓝色;不能;因为混合气体中可能含H2O,会干扰H2的检验;
(4)酸性高锰酸钾有强氧化性,能氧化二氧化硫而使其褪色,所以检验亚铁离子的方法是:取A的溶液,滴加酸性高锰酸钾溶液,若红色褪去,证明有Fe2+,
故答案为:取A的溶液,滴加酸性高锰酸钾溶液,若红色褪去,证明有Fe2+;
(5)因为浓硫酸中的水很少,浓硫酸有吸水性,硫酸铜不能溶于浓硫酸,所以反应后生成的硫酸铜大多没有溶解出现预计的蓝色溶液,而以白色固体形式存在;
要确认CuSO4生成,待试管冷却后,将浓硫酸倒出,在固体中加水,看溶液是否变蓝色;
故答案为:浓硫酸中的水很少,浓硫酸有吸水性;将浓硫酸倒出,在固体中加水,看溶液是否变蓝色.
点评 本题考查性质实验方案的设计,为高频考点,把握反应原理、物质的性质、实验装置的作用为解答的关键,注意亚铁离子、铁离子的检验方法,侧重分析与实验能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NaHSO4是硫酸盐 | B. | NaHSO4是酸式盐 | C. | NaHSO4是钠盐 | D. | NaHSO4是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知常温下AgCl的溶解度远大于AgBr,现将AgCl和AgBr的两种饱和溶液等体积混合后,再加入足量浓AgNO3溶液,生成的AgCl沉淀多于AgBr沉淀 | |
| B. | Fe(OH)3溶于氢碘酸的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 甲基橙呈黄色的溶液中,I-、Cl-、NO3-、Na+一定可以大量共存 | |
| D. | 已知甲烷的燃烧热为890.3kJ•mol-1,则表示甲烷燃烧热的热化学方程式为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
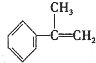 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式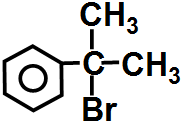 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内气体C的物质的量不再改变 | |
| B. | 容器内混合气体的A、B、C的浓度之比为1:3:2 | |
| C. | 单位时间内生成 n mol的A,同时消耗2n mol的C | |
| D. | 正、逆反应均不再进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 发生酯化反应的产物A是一种食用香料;11.6g甲完全燃烧可产生0.6mo1CO2和0.6mo 1H2O.相同条件下,甲蒸气对氧气的相对密度为1.8125,甲分子为链状结构且不含甲基.
发生酯化反应的产物A是一种食用香料;11.6g甲完全燃烧可产生0.6mo1CO2和0.6mo 1H2O.相同条件下,甲蒸气对氧气的相对密度为1.8125,甲分子为链状结构且不含甲基. 生成A的化学方程式为
生成A的化学方程式为  $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com