
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
分析 (1)电极材料由NiO2、Fe和碳粉涂在铝箔上制成,放电过程中产生Ni(OH)2和Fe(OH)2,铁做负极,NiO2做正极发生还原反应生成Ni(OH)2,结合电荷守恒和原子守恒配平书写电极反应;
(2)依据I=$\frac{P}{U}$,Q=tI,电池工作时铁失电子发生氧化反应生成+2价铁,结合电子守恒计算;
(3)废电池电极材料加入盐酸溶解,得到氯化镍、氯化亚铁、氯化铝,加入适量双氧水的目的是将溶液中的Fe2+氧化为Fe3+,加入NiO的目的是调节溶液PH值,先后沉淀铁离子和铝离子,加入NiO固体,则开始析出沉淀时的离子方程式是:NiO+2H+=Ni2++H2O,Fe3++3H2O=Fe(OH)3↓+3H+,铝离子后沉淀,当铝离子浓度小于或等于1×10-5mol/L为完全沉淀,Al(OH)3的Ksp=2.0×10-32,则此时c(OH-)3=$\frac{{K}_{SP}}{c(A{l}^{3+})}$=$\frac{2.0×1{0}^{-32}}{1×1{0}^{-5}}$,c(OH-)=$\root{3}{2}×1{0}^{-9}$mol/L,c(H+)=$\frac{{K}_{W}}{c(O{H}^{-})}$=$\frac{1×1{0}^{-14}}{\root{3}{2}×1{0}^{-9}}$,PH=-lg(H+)=5.1,当PH=5.9时,镍离子开始沉淀,则PH控制在5.1~5.9时,铁离子和铝离子都沉淀析出,过滤得到Fe(OH)3,Al(OH)3,氢氧化铝是两性氢氧化物,把氢氧化铁和氢氧化铝溶于过量氢氧化钠溶液中过滤得到滤渣为氢氧化铁沉淀,滤液为偏铝酸钠溶液,再通入过量二氧化碳沉淀出氢氧化铝;
(4)滤液A为氯化钠溶液,电解时阴极得到氢气,阳极得到氯气;通入的气体为Cl2,氯气、氢氧化钠溶液和NiC2O4•H2O反应生成Ni(OH)3.
解答 解:(1)电极材料由NiO2、Fe和碳粉涂在铝箔上制成,放电过程中产生Ni(OH)2和Fe(OH)2,铁做负极,NiO2做正极发生还原反应生成Ni(OH)2,结合电荷守恒和原子守恒配平书写电极反应为:NiO2+2H2O+2e-=Ni(OH)2+2OH-,
故答案为:Fe;NiO2+2H2O+2e-=Ni(OH)2+2OH-;
(2)电池输出电压为3V,给2W灯泡供电,电流I=$\frac{P}{U}$=$\frac{2}{3}$A,消耗0.02gFe,铁失电生成+2价铁,电子转移总物质的量=$\frac{0.02g}{56g/mol}$×2=0.000714mol,
理论电池工作时间t=$\frac{Q}{I}$=$\frac{0.000714mol×96500C/mol}{\frac{2}{3}A}$=103.3515s≈1.72min,
故答案为:1.72;
(3)方案中加入适量双氧水的目的是将溶液中的Fe2+氧化为Fe3+,加入NiO的目的是调节溶液PH值,先后沉淀铁离子和铝离子,加入NiO固体,则开始析出沉淀时的离子方程式是:NiO+2H+=Ni2++H2O,Fe3++3H2O=Fe(OH)3↓+3H+,铝离子后沉淀,当铝离子浓度小于或等于1×10-5mol/L为完全沉淀,Al(OH)3的Ksp=2.0×10-32,则此时c(OH-)3=$\frac{{K}_{SP}}{c(A{l}^{3+})}$=$\frac{2.0×1{0}^{-32}}{1×1{0}^{-5}}$,c(OH-)=$\root{3}{2}×1{0}^{-9}$mol/L,c(H+)=$\frac{{K}_{W}}{c(O{H}^{-})}$=$\frac{1×1{0}^{-14}}{\root{3}{2}×1{0}^{-9}}$,PH=-lg(H+)=5.1,当PH=5.9时,镍离子开始沉淀,则PH控制在5.1~5.9时,铁离子和铝离子都沉淀析出,过滤得到Fe(OH)3,Al(OH)3,氢氧化铝是两性氢氧化物,把氢氧化铁和氢氧化铝溶于过量氢氧化钠溶液中过滤得到氢氧化铁沉淀,滤液为偏铝酸钠溶液,再通入过量二氧化碳沉淀出氢氧化铝,具体步骤为:将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3,
故答案为:将溶液中的Fe2+氧化为Fe3+;NiO+2H+=Ni2++H2O;Fe3++3H2O=Fe(OH)3↓+3H+;5.1~5.9之间;将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3;
(4)滤液A为氯化钠溶液,电解时阴极得到氢气,阳极得到氯气;要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的C即Cl2,
故答案为:NaCl溶液;H2;Cl2;C;要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的Cl2.
点评 本题考查了物质分离提纯实验过程分析判断,涉及原电池原理的理解应用和电极反应书写、电子守恒的计算、难溶电解质的计算、电解综合运用,综合性强,计算量大,有一定难度.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯乙烯(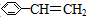 ) ) | B. | 苯甲酸(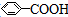 ) ) | C. | 苯甲醛(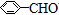 ) ) | D. | 苯乙酮(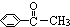 ) ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维、氧化铝陶瓷、硅藻土都是无机非金属材料 | |
| B. | 节能减排防治PM2.5,PM2.5是指大气中直径小于或等于2.5纳米的可吸入颗粒物 | |
| C. | 汽车尾气中的氮氧化物和碳氢化合物在大气环境中受强烈的太阳紫外线照射后产生一种新的二次污染物-光化学烟雾也会引起雾霾,汽车尾气中含有氮氧化物的原因是汽油燃烧不充分 | |
| D. | 超级病菌NDM-l几乎对所有抗生素都具有抗药性,死亡率很高.为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等氧化性强的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.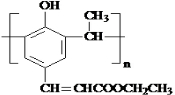 .
. +
+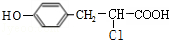 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 广告语“农家肥蔬菜,无公害,绝对不含任何化学物质” | |
| B. | 医用酒精是利用了乙醇的氧化性来杀菌消毒的 | |
| C. | 面食加工时加入少量苏打粉时是防止酸败,加入少量小苏打粉时是作膨松剂 | |
| D. | 空气质量日报中计入污染指数的项目为可吸入颗粒物、SO2、NOx、CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  CO2通入KOH和Ca(OH)2的混合稀溶液 | B. |  CO2通入澄清石灰水中 | ||
| C. | 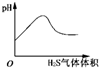 H2S气体通入氯水中 | D. |  NaOH溶液滴入Ba(HCO3)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 相 关 实 验 | 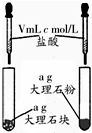 | 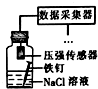 | 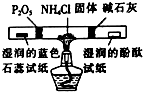 |  |
| 目的 | 探究接触面积对反应速率的影响 | 判断铁钉的 腐蚀类型 | 检验NH4Cl的 分解产物 | 直接蒸干FeSO4饱和溶液制备无水FeSO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | B. | 乙酸的分子式为:C2H4O2 | ||
| C. | 乙醛的结构简式:CH3COH | D. | 比例模型 可以表示CO2 分子 可以表示CO2 分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com