
(16分)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I、摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水搅拌、过滤。并进行如下实验
(1)、请完成表格中的填空:
| 实验步骤 | 实现现象 | 反应的离子方程式 |
| 往滤渣中加入过量NaOH溶液。 |
| ① |
| 过滤,往所得滤液中通入过量二氧化碳, | ② | ③ |
| 继续加入过量稀盐酸 | ④ |
|
II、牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(2)、实验过程中先后两次鼓入空气,第二次鼓入空气的目的是:
。
(3)、C中反应生成BaCO3的化学方程式是 。
(4)、下列各项措施中,不能提高测定准确度的是 (填标号)。
A.在加入盐酸之前,应排净装置内的CO2气体
B.滴加盐酸不宜过快
C.在A—B之间增添盛有浓硫酸的洗气装置
D.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)、实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g.则样品中碳酸钙的质量分数为 。
(6)、某同学提出将C中的Ba(OH)2换成浓H2SO4 ,通过测定D装置反应前后的质量差也可以测定CaCO3的含量,假设反应前D装置的质量为m1,实验结束后D装置的质量为m2,则样品中CaCO3的质量为 。实验证明按此测定的结果偏高,原因是 。
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2012-2013学年吉林省长春市十一高中高一上学期期末考试化学试卷(带解析) 题型:填空题
(12分)手持技术又称掌上技术,是由数据采集器、传感器和配套的软件成
的定量采集各种常见数据并能与计算机连接的实验技术系统。某研究小组利用手持技术,获得8.34gFeS04·7H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。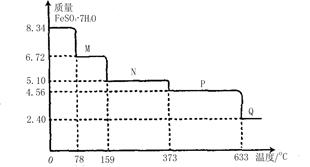
请回答下列问题:
(1)试确定78℃时固体物质M的化学式: 。
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成且两种气体的组成元素相同,摩尔质量相差16,写出该反应的化学方程式 。
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。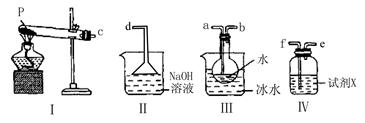
①试剂X的名称是 。
②按气流方向连接各仪器,用字母表示接口的连接顺序:c 。
③充分反应后,利用装置Ⅲ中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。第三步:继续烘干、冷却并称量直至连续两次 称量的质量差不超过0.1g为止。若最终得到沉淀的质量为Wg,则已分解的P的质量为 (填计算式)。
④上述测得P的质量比实际分解质量要小,原因是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省四地六校高一第二次月考化学试卷 题型:实验题
( 16分)某兴趣小组拟利用如下图装置探究验证干燥的Cl2和潮湿的C l2有无漂白性。
l2有无漂白性。
回答下列问题:
(1)A装置中的主要玻璃仪器有:导管、酒精灯、圆底烧瓶、 。
A装置中发生反应的化学方程式是 。
F装置中的试剂应为 ,作用为 。
(2)按气体从左向右流向将各装置依次连接起来(填接口标号): a 接 ,
接 , 接 , 接 , 接 。
。
(3)通入Cl2后,从集气瓶A、B中 红色布条的现象可得出的结论是
红色布条的现象可得出的结论是
;其中发生的反应的化学方程式为 。
(4)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是
。
(5)烧杯E中发生反应的化学方程式为 。
(6)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛4 mol·L-1的NaOH溶液的体积至少应为 mL。
查看答案和解析>>
科目:高中化学 来源:2015届吉林省长春市高一上学期期末考试化学试卷(解析版) 题型:填空题
(12分)手持技术又称掌上技术,是由数据采集器、传感器和配套的软件成
的定量采集各种常见数据并能与计算机连接的实验技术系统。某研究小组利用手持技术,获得8.34gFeS04·7H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。

请回答下列问题:
(1)试确定78℃时固体物质M的化学式: 。
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成且两种气体的组成元素相同,摩尔质量相差16,写出该反应的化学方程式 。
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。

①试剂X的名称是 。
②按气流方向连接各仪器,用字母表示接口的连接顺序:c 。
③充分反应后,利用装置Ⅲ中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。第三步:继续烘干、冷却并称量直至连续两次 称量的质量差不超过0.1g为止。若最终得到沉淀的质量为Wg,则已分解的P的质量为 (填计算式)。
④上述测得P的质量比实际分解质量要小,原因是 。
查看答案和解析>>
科目:高中化学 来源:0110 模拟题 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com