
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。则原混合物中单质铁的质量是
| A.2.24g | B.3.36g | C.5.60g | D.10.08g |
C
解析试题分析:根据溶液中还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没有Fe只有Cu,因为单质铁会与H+反应,而Cu可以残留说明溶液中没有Fe3+,因为Fe3+能与Cu反应。因此溶液中存在的阳离子为H+和Fe2+.阴离子只为氯离子。故n(H+)+2n(Fe2+)=n(Cl-)根据原子守恒和得失电子总数相等计算,反应有:CuO+2H+═Cu2++H2O,
Fe2O3+6H+═2Fe3++3H2O,
Fe+2Fe3+═3Fe2+,
Fe+Cu2+═Fe2++Cu,
Fe+2H+═Fe2++H2↑.
由。n(H+)+2n(Fe2+)=n(Cl-)据原子守恒和得失电子总数相等可知n(H+)=0.4乘以0.2等于0.08 而n(Cl-)=0.1乘以4.4等于0.44 算得出n(Fe2+)="0.18" mol.据反应可知溶液中剩余的Fe2主要来源于Fe+2H+═Fe2++H2↑.Fe+2Fe3+═3Fe2+,Fe+Cu2+═Fe2++Cu,这三个反应。由题意可知残留固体1.28克,其实就是铜的质量即0.02摩尔的铜。由Fe+Cu2+═Fe2++Cu算得出,这个反应消耗的铁单质为0.02摩尔,生成的Fe2为0.02摩尔。再由+ Fe+2H+═Fe2++H2↑可知,只有这个反应放出氢气,所以氢气的物质的量为0.869除以22.4等于0.04摩尔即在这个反应中消耗了铁单质0.04摩尔,同时生成了0.04摩尔的Fe2+。所以可知由Fe+2Fe3+═3Fe2生成的Fe2为0.18减去0.02减去0.04等于0.12摩尔。由反应Fe+2Fe3+═3Fe2可知,在这个反应中消耗了0.04摩尔的铁单质,所以综合这三个反应可知,总共消耗了铁单质为0.04+0.04+0.02等于0.1摩尔,所以铁单质的质量为5.6g
考点:考查物质的量以及电荷守恒的相关知识点。


科目:高中化学 来源: 题型:实验题
硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。请填写以下空白:
【提出问题】Na2S2O3是否与Na2SO4相似具备下列性质呢?
猜想①:________________________。 猜想②:溶液呈中性,且不与酸反应。
猜想③:无还原性,不能被氧化剂氧化。
【实验探究】基于上述猜想②、③,设计实验方案。请填写下列表格中的(1)(2)(3)。
| | 实验操作 | 实验现象 或预期实验现象 | 现象解释 (用离子方程式表示) |
| 猜想② | | 溶液pH约8—10 | |
| 向pH=2的硫酸中滴加Na2S2O3溶液 | | S2O32—+2H+=S↓+SO2↑+H2O | |
| 猜想③ | 向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中不正确的是 ( )
| A.向滴有酚酞的水中加入过量Na2O2粉末并振荡,溶液由无色变红又变无色 |
| B.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明Na2O2与H2O反应是一个放热反应且有氧气生成 |
| C.Na2O2与H2O反应是一个氧化还原反应,Na2O2既是氧化剂,又是还原剂 |
| D.Na2O2与H2O反应是一个置换反应,有单质O2产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将物质的量均为a mol的Na和Al一同投入m g足量水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度为
A.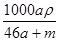 mol·L-1 mol·L-1 | B.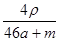 mol·L-1 mol·L-1 |
C. mol·L-1 mol·L-1 | D.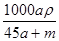 mol·L-1 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某温度下,w克某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加w克。在①H2 、②CO、 ③CO和H2的混合气、④C6H12O6中( )
| A.均不符合 | B.只有①② | C.只有①②③ | D.全部符合 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼
金属铝。下列说法不正确的是( ) 
| A.①、②中除加试剂外,还需要进行过滤操作 |
| B.a、b中铝元素的化合价相同 |
| C.③中需要通入过量的氨气 |
| D.④进行的操作是加热,而且d一定是氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列根据实验事实得出的结论正确的是
| | 实 验 事 实 | 结 论 |
| A | 加热的铝箔熔化,但液态的铝不滴落 | 熔点:氧化铝>铝 |
| B | 溶液中加入盐酸酸化的BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
| C | 碳酸钠溶液能使酚酞试液变红 | 碳酸钠溶液呈碱性 |
| D | 常温下,铜与冷的浓H2SO4不反应 | 铜与浓硫酸发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在硫酸铝、硫酸钾和明矾[KAl(SO4)2·12H2O]的混合溶液中,SO42—的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
| A.0.225mol/L | B.0.25mol/L | C.0.45mol/L | D.0.9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法不正确的是
| A.合金的性质与其成分金属的性质不完全相同 |
| B.工业上金属Mg、Al都是用电解熔融的氯化物制得的 |
| C.金属冶炼的本质是金属阳离子得到电子变成金属原子 |
| D.越活泼的金属越难冶炼 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com