
【题目】实验室欲用NaOH固体配制1.0mol·L-1的NaOH溶液240mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为___。必须用到的玻璃仪器有烧杯、玻璃棒、___。
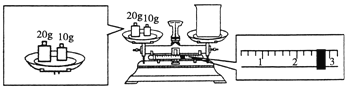
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的态如图所示。烧杯的实际质量为___g,要完成本实验该同学应称出___gNaOH。
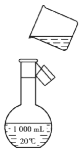
(3)使用容量瓶前必须进行的一步操作是___。
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:
①____;
②____;
(5)在配制过程中,下列操作会引起误差偏高的是___(填字母)。
A.所用NaOH已经潮解
B.向容量瓶加水定容时眼睛俯视液面
C.转移时没有洗涤玻璃棒和烧杯
D.溶解后溶液没有冷却至室温就转移
E.容量瓶没有干燥处理
【答案】②①③⑧⑤⑥⑦④ 250mL容量瓶、胶头滴管 27.4 10.0 查漏 没有玻璃棒引流 没有选用250 mL的容量瓶 BC
【解析】
(1)配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等;根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)根据m左=m右+m游可知烧杯的质量;根据n=cV和m=cVM来计算出所需的NaOH的质量;
(3)容量瓶使用前必须查漏;
(4)根据转移液体的规范操作回答;
(5)根据c=![]() 进行误差分析。
进行误差分析。
(1)配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,所以正确的操作顺序为②①③⑧⑤⑥⑦④;由于无240mL容量瓶,故选用250mL容量瓶,配制出的是250mL溶液,一般用托盘天平称量,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌加速溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所以所需仪器有托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故还需的仪器是250ml容量瓶、胶头滴管;
(2)据图可知,砝码的质量为30g,游码的质量为2.6g,但将砝码和烧杯放反了,而当物品和砝码放反时,m物=m砝-m游=30g-2.6g=27.4g;由于无240mL容量瓶,故选用250mL容量瓶,配制出的是250mL1.0mol/L的NaOH溶液,所需NaOH的质量m=cVM=0.25L×1.0mol/L×40g/mol =10.0g;
(3)带塞子的容器使用前要先检查是否漏水,故容量瓶使用前必须查漏。
(4)要选用250 mL容量瓶定容,移液时要用玻璃棒引流,错误是①没有玻璃棒引流;②没有选用250 mL的容量瓶;
(5)A.所用NaOH已经潮解,溶质氢氧化钠偏少,则浓度偏低,故不选A;
B.定容时俯视刻度线,会导致溶液体积偏小,则浓度偏高,故选B;
C.未冷却到室温就将溶液转移到容量瓶并定容,则待冷却后溶液体积偏小,浓度偏高,故选C;
D.容量瓶没有干燥处理,无影响,故不选D。


科目:高中化学 来源: 题型:
【题目】I.某实验小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
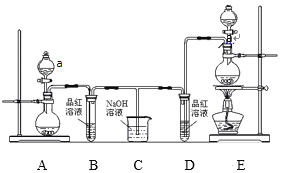
(1)仪器a的名称是 _________。
(2)利用图中E装置进行实验室制备Cl2的离子方程式是_________。
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是_______________。
(4)装置C的作用是_____________。
II.该小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验。
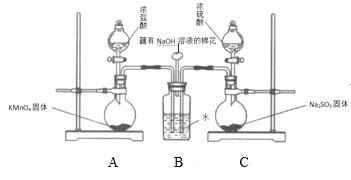
其中装置A制取氯气,装置C制取SO2:
(1)甲同学认为若SO2和Cl2反应,则应有Cl-生成,只要检验到生成的Cl-即可,甲取适量B中样品于试管中,向其中滴加少量_________溶液,有白色沉淀生成。
(2)乙同学认为甲同学的结论不合理,认为应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法实验即可得到正确结论。洗气瓶中盛有的试剂是_________。
(3)丙同学认为按乙同学的建议改进实验也不合理,理由是:___________。
(4)丙同学取BaCl2溶液于试管中,加入少量反应后B中的溶液,生成大量白色沉淀,得出正确结论:SO2与Cl2同时通入水中能相互发生反应,反应的化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将70g过氧化钠和氧化钠混合物与98g水充分反应,所得溶液恰好能被含硫酸98g的酸溶液中和,求:
(1)原混合物中过氧化钠和氧化钠的质量分别是多少?___
(2)所得氢氧化钠溶液的质量分数是多少?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计出燃料电池使汽油(设其成分为C5H12)氧化直接产生电流是21世纪最富有挑战性的课题之一。最近有人设计了一种固体燃料电池,固体氧化铝——氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如右图所示,其中多孔电极a、b均不参与电极反应。下列判断不正确的是
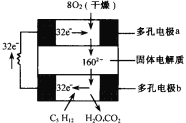
A.有O2放电的a极为电池的负极
B.b极对应的电极反应式为:C5H12+16O2--32e-=5CO2+6H2O
C.该电池的总反应方程式为:C5H12+8O2=5CO2+6H2O
D.汽油燃料电池最大的技术障碍是氧化反应不完全,产生炭粒堵塞电极的气体通道,从而使输电效能减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛有200mL3mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉质量为( )
A.10.8gB.7.2gC.5.4gD.3.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A. 含有NA个氧原子的氧气在标准状况下的体积约为22.4 L
B. 2 L 0.3 mol·L-1的硫酸钾溶液中钾离子浓度为0.6 mol·L-1
C. 常温常压下,32 g O2和O3的混合气体所含原子数为2NA
D. 25 ℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四苯基乙烯(TFE)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。以下是TFE的两条合成路线(部分试剂及反应条件省略):
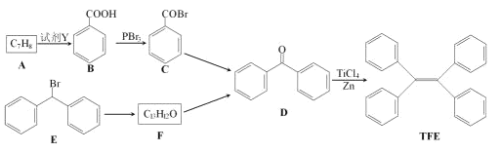
已知反应:![]() 。
。
回答下列问题:
(1)TFE的分子式为______________。
(2)A的名称为______________。
(3)A→B,E→F的反应类型分别为______________、______________。
(4)F→D的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( )
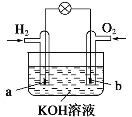
A.a极是负极,该电极上发生氧化反应
B.总反应方程式为2H2+O2═2H2O
C.b极反应是O2+4OH--4e-═2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图所示。

(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接___;__接__。
(2)装置中,饱和食盐水的作用是___;NaOH溶液的作用是___。
(3)化学实验中常用湿润的KI-淀粉试纸检验是否有Cl2产生。如果有Cl2产生,可观察到___,反应的化学方程式为___。
(4)写出下列反应的化学方程式:
①气体发生装置中进行的反应:___。
②NaOH溶液中发生的反应:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com