
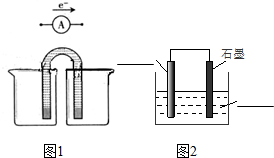
| A | B | C | D | |
| 两极材料 | 石墨、石墨 | Zn片、Cu片 | Zn片、Cu片 | 石墨、Cu片 |
| 插入溶液 | H2SO4溶液 | 乙醇溶液 | 稀盐酸 | H2SO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 形成原电池的条件有:①两种活泼性不同的电极②电解质溶液③闭合回路④能自发进行氧化还原反应,根据原电池构成条件分析解答.
解答 解:A.该装置中两个电极材料相同,且不能自发的进行氧化还原反应,所以不能构成原电池,故A错误;
B.乙醇是非电解质,不能自发的进行氧化还原反应,所以不能构成原电池,故B错误;
C.Zn和Cu的活动性不同,且能自发的进行氧化还原反应,符合原电池构成条件,所以能构成原电池,故C正确;
D.该装置不能自发的进行氧化还原反应,所以不能构成原电池,故D错误;
故选C.
点评 本题考查原电池原理,明确原电池构成条件是解本题关键,这几个条件必须同时具备,缺一不可,这种类型的题紧扣原电池条件分析判断即可,题目难度不大.


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有1molFe(OH)3的氢氧化铁胶体中,含有NA个Fe(OH)3胶粒 | |
| B. | 1mol-L-1Na2CO3溶液100mL,含有0.1NA个CO32- | |
| C. | 足量的铁与1molCl2充分反映转移的电子数为3NA | |
| D. | 高温常压下,22.4L的一氯甲烷中含有的分子数小于NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将含0.1molFeCl3的溶液滴加到沸水中完全水解可生成0.1NA个Fe(OH)3胶粒 | |
| B. | 常温常压下,0.1molD216O中含中子数、质子数、电子数均为NA | |
| C. | 将0.1molCl2通入1L水中,转移的电子数为0.1NA | |
| D. | 电解饱和食盐水,当阴极产生1.12LH2时,转移的电子数一定为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe和盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | Cu和AgNO3溶液反应:Cu+Ag+=Cu2++Ag | |
| C. | 石灰石和盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 氢氧化钡与盐酸反应:OH-+H+=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
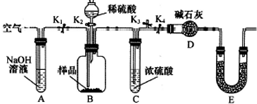 某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.
某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.硫酸/mol•L-1 | 黑色物质出现的温度/°C | 黑色物质消失的温度/°C |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 | B. | C2H4O | C. | C2H6 | D. | C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+c(H2CO3) | |
| B. | 在pH=8的NaB溶液中:c(Na+)-c(B-)=9.9×10-7 mol/L | |
| C. | 浓度均为0.1 mol/L的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3) | |
| D. | 向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≥20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
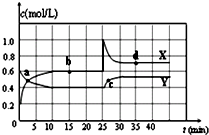 在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图.
在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com