
 )俗称为肉桂酸苄酯,主要用在配制人造龙涎香,在东方型香精中作为定香剂,也用作皂用、化妆用及食用果实香精的调香原料.以下是我校化学兴趣小组设计的由芳香烃A为起始原料制备肉桂酸苄酯的合成路线:
)俗称为肉桂酸苄酯,主要用在配制人造龙涎香,在东方型香精中作为定香剂,也用作皂用、化妆用及食用果实香精的调香原料.以下是我校化学兴趣小组设计的由芳香烃A为起始原料制备肉桂酸苄酯的合成路线:

 ;
;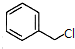 +
+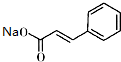 $\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$
$\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$ +NaCl;
+NaCl; (写结构简式,若有多种可能,只写一种).
(写结构简式,若有多种可能,只写一种). 分析 根据G的结构简式结合B、F的分子式可知,B为 ,F为
,F为 ,A与氯气发生取代反应生成B,所以A为
,A与氯气发生取代反应生成B,所以A为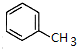 ,A与氯气发生二元取代得C为
,A与氯气发生二元取代得C为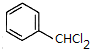 ,C发生碱性水解结合信息①可得D为
,C发生碱性水解结合信息①可得D为 ,D发生信息②中的反应得E为
,D发生信息②中的反应得E为 ,E与氢氧化钠反应生成F,符合各物质转化关系,据此答题.
,E与氢氧化钠反应生成F,符合各物质转化关系,据此答题.
解答 解:根据G的结构简式结合B、F的分子式可知,B为 ,F为
,F为 ,A与氯气发生取代反应生成B,所以A为
,A与氯气发生取代反应生成B,所以A为 ,A与氯气发生二元取代得C为
,A与氯气发生二元取代得C为 ,C发生碱性水解结合信息①可得D为
,C发生碱性水解结合信息①可得D为 ,D发生信息②中的反应得E为
,D发生信息②中的反应得E为 ,E与氢氧化钠反应生成F,符合各物质转化关系,
,E与氢氧化钠反应生成F,符合各物质转化关系,
(1)根据上面的分析可知,由A生成B的反应类型是取代反应,E为 ,E的俗名是肉桂酸,
,E的俗名是肉桂酸,
故答案为:取代反应;肉桂酸;
(2)C为 ,C的核磁共振氢谱中有4个吸收峰,(C2H5)3N/NaI/△
,C的核磁共振氢谱中有4个吸收峰,(C2H5)3N/NaI/△
故答案为:4;
(3)根据上面的分析可知,D的结构简式是 ,
,
故答案为: ;
;
(4)E为 ,F为
,F为 ,E、F都有碳碳双键,都有顺反异构,其它物质不含有碳碳双键,也不存在顺反异构,
,E、F都有碳碳双键,都有顺反异构,其它物质不含有碳碳双键,也不存在顺反异构,
故答案为:E、F;
(5)由B和F生成G的化学方程式为 +
+ $\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$
$\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$ +NaCl,
+NaCl,
故答案为: +
+ $\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$
$\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$ +NaCl;
+NaCl;
(6)E为 ,能发生银镜反应,说明有醛基,与FeCl3溶液发生显色反应,说明有酚羟基,符合条件的E的同分异构体为苯环上连有两个基团为-OH、-CH=CHCHO或-OH、-C(CHO)=CH2,分别有邻间对三种结构,所以这样的结构有6种,也可以是苯环上连有三个基团,分别为-CHO、-OH、-CH=CH2,根据定二动一的原则,这样的结构有10种,所以共有16种,其中一取代物只有两种,说明有两个取代基位于苯环的对位,其结构为
,能发生银镜反应,说明有醛基,与FeCl3溶液发生显色反应,说明有酚羟基,符合条件的E的同分异构体为苯环上连有两个基团为-OH、-CH=CHCHO或-OH、-C(CHO)=CH2,分别有邻间对三种结构,所以这样的结构有6种,也可以是苯环上连有三个基团,分别为-CHO、-OH、-CH=CH2,根据定二动一的原则,这样的结构有10种,所以共有16种,其中一取代物只有两种,说明有两个取代基位于苯环的对位,其结构为 ,
,
故答案为:16; .
.
点评 本题以肉桂酸苄酯为载体考查官能团性质、同分异构体、有机反应类型等,题目中有机物的结构复杂,能较好的考查学生的阅读、分析与思维能力,是热点题型,难度较大,注意根据有机物的结构特点及反应条件进行推断.


科目:高中化学 来源: 题型:解答题
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,A的简单离子半径是同周期元素简单离子中半径最小的.请回答下列问题:
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,A的简单离子半径是同周期元素简单离子中半径最小的.请回答下列问题: .
. .该阳离子中存在的化学键有共价键,写出该阳离子与F氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
.该阳离子中存在的化学键有共价键,写出该阳离子与F氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 遇苯酚显紫色的溶液:Na+、Al3+、Cl-、SCN- | |
| B. | 使甲基橙变红色的溶液:K+、Mg2+、SO42-、NO3- | |
| C. | 加入淀粉碘化钾溶液变蓝色的溶液:Na+、CO32-、HSO3-、OH- | |
| D. | 由水电离产生的c(H+)=10-12 mol•L-1的溶液中:NH4+、SO42-、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cu2+、Cl-、AlO2- | B. | Na+、Al3+、NO3-、HCO3- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Ca2+、Cl-、CO32-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
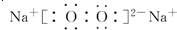 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由铜、锌和稀硫酸组成的原电池中:
由铜、锌和稀硫酸组成的原电池中:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com