
| A. |  | B. |  | C. | 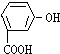 | D. | 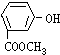 |
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:填空题
| HX | HY | HZ | |
| 浓度 mol•L-1 | 0.1 0.5 | 1.0 1.5 | 2.0 2.5 |
| 电离度 | 0.3% 0.13% | 0.3% 0.24% | 0.5% 0.45% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的有效成分是Ca(ClO)2和CaCl2 | |
| B. | 漂白粉在空气中久置后会变质 | |
| C. | 漂白粉的有效成分Ca(ClO)2不稳定,易分解 | |
| D. | 漂白粉的主要成分是CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①②③④ | C. | ③④⑤ | D. | 全部都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 置换反应的通式可表示为如图所示:请回答下列问题:
置换反应的通式可表示为如图所示:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2O和CO2分子中的中心原子均采用sp2杂化 | |
| B. | CH3SH 的相对分子质量比CH3OH大,因此前者的沸点高 | |
| C. | C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子 | |
| D. | 甲胺(分子式CH3NH2)的沸点比三甲胺[分子式(CH3)3N]的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn与稀H2SO4反应:Zn+H+═Zn2++H2↑ | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | Cl2与NaOH溶液反应:Cl2+2OH-═2Cl-+H2O | |
| D. | MgCl2溶液与过量氨水反应:Mg2++2OH-═Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丁烯和环己烷 | B. | 1-庚烯和3-甲基-1-丁烯 | ||
| C. | 1-氯丙烷和2-氯丙烷 | D. | 甲苯和乙苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com