
A.N2(g)+3H2(g)  2NH3(g);△H<0 2NH3(g);△H<0 |
B.H2(g)+I2(g)  2HI(g);△H<0 2HI(g);△H<0 |
C.2SO3(g)  2SO2(g)+O2(g);△H>0 2SO2(g)+O2(g);△H>0 |
D.4NH3(g)+5O2(g)  4NO(g)+6H2O(g);△H<0 4NO(g)+6H2O(g);△H<0 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
 pC(g)+qD(g),根据图回答:
pC(g)+qD(g),根据图回答:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2+3H2在密闭容器中进行,达到平衡状态的标志是( )
N2+3H2在密闭容器中进行,达到平衡状态的标志是( )| A.①④⑤ | B.②③⑤? | C.①③④ | D.①②③④⑤? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g),一段时间后达到平衡,生成a molC。则下列说法中正确的是( )
2C(g),一段时间后达到平衡,生成a molC。则下列说法中正确的是( )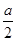 )
) 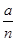
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC (g)+q(g);△H<0。下列结论中不正确的是( )
pC (g)+q(g);△H<0。下列结论中不正确的是( ) 查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题

 (1)2 min时,容器内n(N2)== ,c(H2)== 。
(1)2 min时,容器内n(N2)== ,c(H2)== 。
 (3)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为:
(3)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为:查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率vA vC(同上)。
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率vA vC(同上)。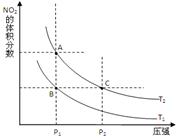
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
 N2O4(g)的平衡常数K的值为 。
N2O4(g)的平衡常数K的值为 。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.缩小容器体积,使压强增大 | B.保持体积不变,充入O2 |
| C.保持体积不变,充入氦气 | D.保持压强不变,充入氦气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫酸工业中SO2转化为SO3时采用常压,是因为增大压强不会提高SO2的转化率。 |
| B.打开啤酒瓶的瓶盖,大量的气泡冒出来,该现象不能用勒夏特列原理解释。 |
| C.氯碱工业:用离子交换膜电解槽电解时,往阳极室注入经过精制的 NaCl溶液,往阴极室注入稀氢氧化钠溶液(或去离子水)。 |
| D.工业上合成氨采用500℃左右的温度,其原因是适当加快NH3的合成速率,催化剂在500℃左右时其活性最好,且能提高H2的转化率。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com