
【题目】下列说法正确是
A. 酸性HClO4>H3PO4,是因为HClO4分子非羟基氧原子数目比H3PO4多
B. 分子晶体中都存在共价键;晶体中只要有阳离子就一定有阴离子
C. HF稳定性很强,是因为分子间能形成氢键
D. 乳酸[CH3CH(OH)COOH]分子中有2个手性碳原子
【答案】A
【解析】
A项,酸性强弱的一条经验规律是:含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强;HClO4分子非羟基氧原子数目为3,H3PO4分子非羟基氧原子数目为1,所以酸性HClO4>H3PO4,故A项正确;
B项,晶体只要有阳离子不一定有阴离子,如金属晶体含有组成微粒为阳离子和电子,故B项错误;
C项,氟化氢的熔沸点上升是因为分子间存在氢键,但是稳定性强是因为氟的非金属性强,故C项错误;
D项,碳原子连接四个不同的原子或原子团时,该碳原子为手性碳原子,所以乳酸![]() 中第二个C为手性碳原子,该分子存在一个手性碳原子,故D项错误。
中第二个C为手性碳原子,该分子存在一个手性碳原子,故D项错误。
综上所述,本题正确答案为A。


科目:高中化学 来源: 题型:
【题目】已知H-H键键能为436kJ/mol,H-N键键能为391kJ/mol,根据化学方程式:N2+3H2![]() 2NH3,反应1molN2时放出92.4kJ的热量,则N≡N键键能是( )
2NH3,反应1molN2时放出92.4kJ的热量,则N≡N键键能是( )
A. 431kJ/mol B. 869kJ/mol C. 649kJ/mol D. 945.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
A | B | C | D | |
强电解质 | Fe | NaCl | CaCO3 | HNO3 |
弱电解质 | CH3COOH | NH3 | H3PO4 | Fe(OH)3 |
非电解质 | C12H22O11(蔗糖) | BaSO4 | C2H5OH | H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 将饱和氯化铁溶液逐滴加入煮沸的蒸馏水中制备氢氧化铁胶体:Fe3+ + 3H2O ![]() Fe(OH)3↓+ 3H+
Fe(OH)3↓+ 3H+
B. 向FeBr2溶液中通入过量Cl2:2Fe2+ + 2Br- + 2Cl2 = 2Fe3++ Br2 + 4Cl-
C. 将NaHCO3溶液与过量的Ca(OH)2溶液混合:HCO3- + OH-+ Ca2+ = CaCO3↓+ H2O
D. 用KIO3氧化酸性溶液中的KI:5I- + IO3- + 3H2O = 3I2 + 6OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃结构简式为 ,其命名正确的是
,其命名正确的是
A. 2-乙基-3,3-二甲基戊烷 B. 3,3-二甲基-4-乙基戊烷
C. 3,3,4-三甲基己烷 D. 3,4,4-三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的工具和基础,下列有关化学用语的表达正确的是
A. H2S 的电离方程式:H2S=2H++S2-
B. 氯化铵的电子式:![]()
C. 钾长石(KAlSi3O8)写成氧化物形式:K2O·Al2O3·6SiO2
D. 反应的电子转移情况: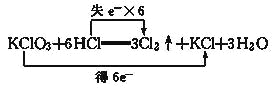
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1、图2分别是甲同学和乙同学设计的制溴苯的装置。已知制备溴苯的反应是放热反应。
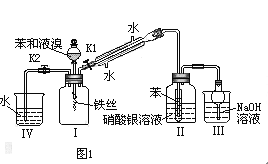
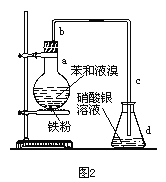
通过分析回答下列问题:
(1)实验室制溴苯的化学反应方程式为:________________________________。
(2)实验时,图1中看到的现象有:
①______________________________________________________。
②______________________________________________________。
(3)图2的操作和现象:
①中先关闭K2,开启K1和漏斗活塞滴加苯和液溴的混合液反应开始,观察到:____________________________________。
②关闭K1和漏斗活塞,开启K2发现___________________________________。
(4)比较两装置,图2优于图1有(答出主要的三点):
①______________________________________________________。
②______________________________________________________。
③______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.化学反应速率只能加快不能减慢
B.增加反应物的用量一定能增大反应速率
C.同质量的镁和铝分别与同浓度盐酸反应剧烈程度相同
D.反应物的性质是决定化学反应速率的主要因素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Q是一种治疗心脏病药物的中间体,其以苯酚为原料的工业合成路线如图所示。
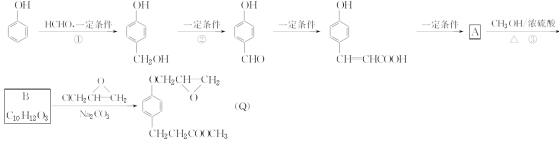
已知:RONa+R′X―→ROR′+NaX
(1)A的分子式为________,B的结构简式为____________________________。
(2)①的化学方程式为__________________________________________。
(3)关于有机物B的说法中,正确的是________。
A.分子中至少有7个碳原子共平面
B.1 mol该有机物与足量NaOH溶液反应,会消耗2 mol NaOH
C.该有机物能发生取代反应、加成反应和氧化反应
D.完全燃烧1 mol该有机物消耗257.6 L氧气
(4)有机物![]() 的含氧官能团的名称为_____,核磁共振氢谱图上共有___个峰,请写出两种满足下列要求的该有机物的同分异构体的结构简式:______。
的含氧官能团的名称为_____,核磁共振氢谱图上共有___个峰,请写出两种满足下列要求的该有机物的同分异构体的结构简式:______。
①能发生银镜反应; ②苯环上有三个互为间位的取代基;
③苯环上一元取代物只有两种同分异构体; ④能与金属钠发生反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com