
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理 ①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式: 。
(2)实验装置(如下图所示)
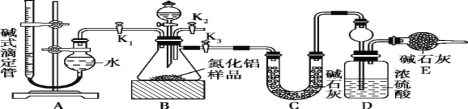
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为y g,滴定管的读数为a mL。
②称取x g AlN样品置于锥形瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入稀硫酸,与烧瓶内物质充分反应,记录滴定管的读数为b mL。
③待反应进行完全后,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量NaOH溶液,与烧瓶内物质充分反应。
④ (填入该步应进行的操作),称得D装置的质量为z g。
(4)数据分析:①AlN的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”“偏小”或“无影响”)。
③Al4C3的质量分数为 (假设该实验条件下的气体摩尔体积为Vm mol/L)。
【答案】(1)AlN+NaOH+H2O![]() NaAlO2+NH3↑
NaAlO2+NH3↑
(3)③K1,K3;④打开K2,通入空气一段时间(或通氮气)
(4)① [41(z-y)/17x ]×100%;②偏小;
③ [71(b-a)/1500xVm ] ×100%或[71(b-a)/15 xVm ] %
【解析】
试题分析:从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数;
(1)根据题目信息:AlN溶于强碱溶液时会生成NH3,化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑。
(3)③用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,故应关闭活塞K1,打开活塞K3。故答案为:K1;K3;NaOH;
④装置中残留部分氨气,打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全 吸收,防止测定的氨气的质量偏小。故答案为:打开K2,通入空气一段时间;
(4)①氨气的质量为(z-y)g,物质的量为(z-y)/17mol,根据氮原子的守恒,氨气的物质的量等
于AlN的物质的量,所以AlN的质量为(z-y)/17mol×41g/mol=41(z-y)/17g,故AlN的质量分数为[41(z-y)/17x ]×100%。故答案为:[41(z-y)/17x ]×100%;
②读取滴定管中气体的体积时,液面左高右低,气体的压强大于大气压,测定气体甲烷的体积偏小。故答案为:偏小;
③甲烷的体积为(b-a)L,物质的量为[(b-a)×10-3]/Vmmol,根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,所以Al4C3的质量为1/3×[(b-a)×10-3]/Vmmol×144g/mol=[71(b-a)/1500xVm ] ×100%或 [71(b-a)/15 xVm ] %。故答案为:[71(b-a)/1500xVm ] ×100%或 [71(b-a)/15 xVm ] %。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
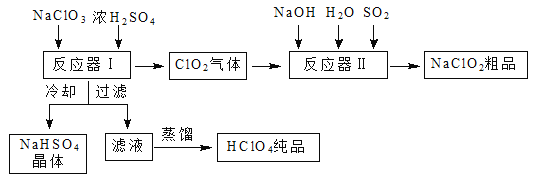
已知:① NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
② 高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是 。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,请写出工业上生产漂白粉的离子方程式: 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为 。(结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原子的一种激发态为1s22s12p1 , 则该元素在周期表中的位置为( )
A.第二周期ⅡA族
B.第二周期ⅢA族
C.第二周期ⅠA族
D.第二周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物与人类的生活、生产紧密联系。
(1)已知1g甲烷完全燃烧生成稳定的氧化物时放出Q kJ的热量,写出表示甲烷燃烧热的热化学方程式:
(2)已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+130 kJ·mol-1,
2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1。断开1 mol H—H键、O===O键分别需要吸收436 kJ、496 kJ的热量,则断开1 mol O—H键需要吸收的热量为
A.332 kJ B.118 kJ
C.462 kJ D.360 kJ
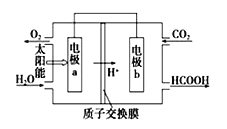
(3)以CO2和H2O为原料制备HCOOH和O2的原电池原理如图.电极a、b表面发生的电极反应式分别为:
a: ,b: .
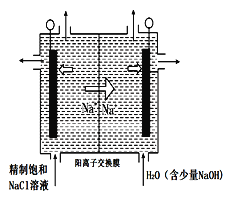
(4)图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2气体。则阳极产生ClO2的电极反应式为_______________________,用平衡移动原理解释阴极区pH增大的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是短周期原子序数依将增大的5种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物的难排于水。下列说法不正确的是 ( )
A. 简单离子的半径:C>D>E>B
B. 工业上常用电解法制得C和D的单质
C. 稳定性: A2B>A2E
D. 单质D可用于冶炼某些难熔金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(共7分)KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:①软锰矿与过量KOH、KClO3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转化为MnO2和KMnO4;③滤去MnO2,将滤液浓缩、结晶得到深紫色的KMnO4产品。
(1)溶液酸化时,K2MnO4转变为MnO2和KMnO4的离子方程式是
;
(2)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。
①配制250 mL0.1 mol/L标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量为 g;
②取上述制得的KMnO4产品0.6000g,酸化后用0.1mol/L标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液20.00 ml。计算该KMnO4产品的纯度(请给出计算过程)。
![]() (有关离子方程式为:MnO4-+S2O32-+H+ SO42-+Mn2++H2O 未配平)
(有关离子方程式为:MnO4-+S2O32-+H+ SO42-+Mn2++H2O 未配平)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为FeSO4溶液,G为CuSO4溶液,它们之间存在如图所示关系:
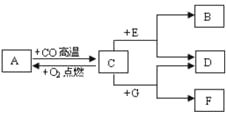
(1)推测下列物质的化学式A ,B ,F 。
(2)写出A→C转化的化学方程式 。
(3)写出C+G→D+F转化的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为新一代饮用水的消毒剂,正逐渐代替Cl2来进行自来水的消毒。请回答下列问题:
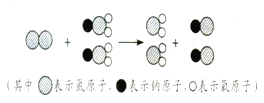
(1)ClO2的名称为 ;
(2)ClO2中氯元素的化合价为 ;
(3)ClO2所属物质类别是 ;
(4)以下微观过程表示制取ClO2的反应 原理,分析以上微观模拟图,你能得出的结论是: 。(写一条)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com