
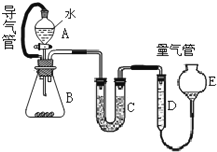
 在金属冶炼和电子工业中,钙常作为空气的除气剂,以除去微量的氮氧.一化学兴趣小组对金属钙在空气中燃烧的产物做了以下探究实验.取一定量的钙在空气中加热,使其充分燃烧,燃烧时火焰呈砖红色,燃烧后得白色固体M.将M研细后称取 4.84g放入锥形瓶B中,滴加适量水使固体完全反应,通过图测量生成的气体体积,进而推算白色固体的成分.
在金属冶炼和电子工业中,钙常作为空气的除气剂,以除去微量的氮氧.一化学兴趣小组对金属钙在空气中燃烧的产物做了以下探究实验.取一定量的钙在空气中加热,使其充分燃烧,燃烧时火焰呈砖红色,燃烧后得白色固体M.将M研细后称取 4.84g放入锥形瓶B中,滴加适量水使固体完全反应,通过图测量生成的气体体积,进而推算白色固体的成分.| 0.448L |
| 22.4L/mol |


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
| A、自来水 |
| B、0.5mol/L盐酸 |
| C、0.5mol/LCH3COOH |
| D、0.5mol/LNH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 加热 |
| 氯化钙溶液 |
| 硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠着火时可用干粉灭火器扑灭 |
| B、在硫酸铜晶体结晶水含量测定的实验中,称量操作至少需要四次 |
| C、铜与浓硫酸反应时,用蘸有浓溴水的棉花放在导管口吸收多余的气体 |
| D、在250 mL烧杯中加入216 mL水和24 g NaOH固体,配制10%NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com