
【题目】下列共价键①H-H、②H-F、③H-O、④N-H 中,键的极性由小到大的顺序正确的是
A. ①②③④B. ④③②①C. ①④③②D. ②③④①
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】水溶液中只可能有K+、Mg2+、AlO2﹣、SiO32﹣、CO32﹣、SO42﹣中的若干种离子.某同学对溶液进行了如图实验:下列判断错误的是( )

A. 有气体甲生成,表明溶液X中一定含有CO32﹣
B. 沉淀甲可能是硅酸镁
C. K+一定存在于溶液X中
D. 不能确定SO42﹣是否存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如下图:
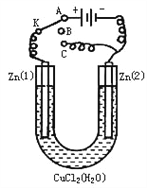
(1)如果把电键K接A,这一装置形成_________装置,Zn①电极反应式是________________________;
(2)上述反应进行5min后,转换电键K到C,这一装置形成____________装置,Zn①极是____极,该装置发生反应的总化学方程式是 ________________________;
(3)上述装置进行2min后,再转换电键K到B,在Zn②极上发生的腐蚀属于_______,被腐蚀的金属是______________,Zn①极发生的腐蚀主要属于__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】善于归纳元素及其化合物之间的转化关系,对学习元素化合物具有重要意义。现有下列物质:金属铁、钠、镁、氯气、氧气、二氧化硫、二氧化碳、水、NaOH溶液、氨水、HCl溶液、KI溶液、HNO3溶液、FeCl2溶液。根据要求回答问题:
(1)置换反应是中学常见基本反应类型之一。
①写出非金属单质置换出非金属单质的离子方程式______________________。
②写出金属单质置换出非金属单质的化学反应方程式______________________。
(2)“三角转化”是单质及其化合物间常见的转化关系之一。现有如图转化关系:
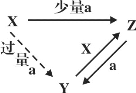
①若X是一种强碱,a是一种酸性氧化物,则Z为_________盐(填“正”或“酸式”)。
②若Z是一种能够与血红蛋白结合造成人体缺氧的气体,则a的名称为___________。
③若X是常见金属单质,a为含氧酸,则Z中金属元素的化合价为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,14g有N2与CO组成的混合气体含有的原子数目为NA个
B.0.5molO3与11.2LO2所含的分子数一定相等
C.标准状况下,22.4L四氯化碳的分子数为NA
D.等物质的量的CO和CH4中碳原子数均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据氯水分别与如图四种物质发生的反应选择正确的表述

A. a反应的离子方程式可能是:2Fe2+ +4Br-+3Cl2 =2Fe3+ +2Br2 +6Cl-
B. b反应中产生无色无味气体,说明HClO的酸性强于H2CO3
C. c反应的现象中知可以直接利用硝酸银溶液检验Cl-
D. d反应的最终现象是紫色石蕊溶液褪色,因为Cl2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前“低碳经济”正成为科学家研究的主要课题。请回答下列问题:
Ⅰ.甲烷自热重整是一种先进的制氢方法,其反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)阅读下图,计算上述反应的反应热ΔH=________kJ·mol-1。

Ⅱ.用CH4或其他有机物、O2为原料可设计成燃料电池。
(2)以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为________________________________________________________________________。
(3)以CH4、O2为原料,100mL0.15mol·L-1NaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中溶质的成分及物质的量之比为________________________,各离子浓度由大到小的顺序为________________________________________________________________________。
Ⅲ.利用I2O5消除CO污染的反应为5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4molCO,测得CO2的体积分数随时间t变化曲线如下图。请回答:
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4molCO,测得CO2的体积分数随时间t变化曲线如下图。请回答:
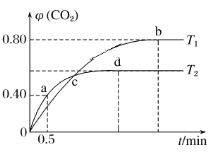
(4)T2时,0~0.5min内的反应速率v(CO)=________________。
(5)T1时化学平衡常数K=________。
(6)下列说法不正确的是________(填标号)。
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,增大体系压强,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数NA的说法正确的是( )
A. 标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA
B. 常温常压下,11gCO2中含有0.75NA个原子
C. 标准状况下,NA个水分子的体积约为22.4L
D. 50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com