
元素周期表中的六种元素①②③④⑤⑥位置如下图所示:
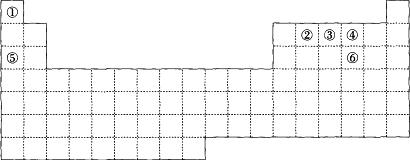
回答下列问题:
(1)由②④⑤三种元素组成的无机物(相对分子质量106),其水溶液呈碱性,用离子方程式表示其原因________.
(2)只含①③④三种元素的一种常见离子化合物中,元素③的化合价分别处于最高价和最低价,则其水溶液中离子浓度的由大到小顺序为________.
(3)元素③的氢化物与元素④单质在一定条件下发生置换反应,在该反应中氧化剂与还原剂的物质的量之比为________.
(4)用惰性电极电解元素⑥的最高价氧化物对应水化物的稀溶液,阳极的电极反应式为________.
(5)由④⑤形成的原子个数1∶1的化合物的电子式为________.
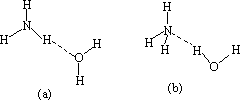
(6)NH3·H2O的电离方程式为NH3·H2O![]() NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是:________
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是:________
(7)利用稀有气体化合物,人们实现了许多制备实验的突破,如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时释放出Xe,写出上述反应的离子方程式:________
 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:阅读理解
 A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:
A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素.
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素.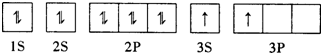
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第4讲 物质结构和元素周期律练习卷(解析版) 题型:填空题
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置__________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)______。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________________________________________________________________________。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:________________________________________________________________________。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______________________________________________________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省潍坊市高三3月第一次模拟考试化学试卷(解析版) 题型:填空题
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题:
(1)元素D在周期表中的位置 。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) 。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型A、B、C三种元素以原子个数比4∶2∶3形成化合物有 。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式: 。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。
(5) 气体有毒,排放到大气中易形成酸雨,写出
气体有毒,排放到大气中易形成酸雨,写出 与氧气和水蒸气反应的化学方程式 。
与氧气和水蒸气反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com