【答案】
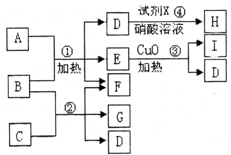
分析:反应④产生白色沉淀,且M(H)为143.5g/mol,可知H为AgCl,故D含有Cl元素且溶于水电离出Cl
-,试剂X为硝酸银溶液;
常温下,A、I都是气态单质,且A和I的一种同素异形体都能使湿润的有色布条褪色且都能用于饮用水消毒,所以A为Cl
2,I为O
2;
反应③属于分解反应生成氧气与D,CuO起催化剂作用,反应生成的D含有Cl元素且溶于水电离出Cl
-,故E为KClO
3,D为KCl,反应①Cl
2+B→KCl+KClO
3+F,氯气发生歧化反应,考虑氯气与碱的反应,B含有K元素,1molB含28mole
-,故B为KOH,F为H
2O;
由反应②KOH+C→H
2O+G+KCl,故C含有Cl元素,C是由第三周期的两种元素组成原子个数比为1:3型化合物,故C为AlCl
3,G为KAlO
2.
解答:解:反应④产生白色沉淀,且M(H)为143.5g/mol,可知H为AgCl,故D含有Cl元素且溶于水电离出Cl
-,试剂X为硝酸银溶液;
常温下,A、I都是气态单质,且A和I的一种同素异形体都能使湿润的有色布条褪色且都能用于饮用水消毒,所以A为Cl
2,I为O
2;
反应③属于分解反应生成氧气与D,CuO起催化剂作用,反应生成的D含有Cl元素且溶于水电离出Cl
-,故E为KClO
3,D为KCl,反应①Cl
2+B→KCl+KClO
3+F,氯气发生歧化反应,考虑氯气与碱的反应,B含有K元素,1molB含28mole
-,故B为KOH,F为H
2O;
由反应②KOH+C→H
2O+G+KCl,故C含有Cl元素,C是由第三周期的两种元素组成原子个数比为1:3型化合物,故C为AlCl
3,G为KAlO
2;
(1)由上述分析可知,B为KOH,由钾离子与氢氧根离子构成,电子式为:
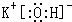
;试剂X为硝酸银溶液;
反应②是过量氢氧化钾与氯化铝反应生成氯化钾、偏铝酸钾、水,反应离子方程式为:4OH
-+Al
3+=AlO
2-+2H
2O,
故答案为:
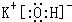
;硝酸银溶液;4OH
-+Al
3+=AlO
2-+2H
2O;
(2)反应③是氯酸钾在催化剂、加热的条件下分解生成氯化钾与氧气,反应方程式为:2KClO
3 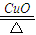
2KCl+3O
2↑;
上述所有物质中形成的晶体类型有:分子晶体、离子晶体;
故答案为:2KClO
3 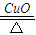
2KCl+3O
2↑;分子晶体、离子晶体;
(3)AlCl
3溶液中Al
3+离子水解,Cl
-与 Al
3+浓度之比大于3,为防止水解,配制氯化铝溶液通常加入盐酸,实验室用AlCl
3晶体配制3mol/L的AlCl
3溶液的操作方法是:取一定量氯化铝晶体溶于一定量较浓的盐酸中,加蒸馏水稀释至3mol/L的氯化铝溶液,
故答案为:大于;取一定量氯化铝晶体溶于一定量较浓的盐酸中,加蒸馏水稀释至3mol/L的氯化铝溶液;
(4)G与C溶液混合反应是偏铝酸钾与氯化铝反应生成氢氧化铝与氯化钾,反应离子方程式为Al
3++3AlO
2-+6H
2O=4Al(OH)
3↓,故答案为:Al
3++3AlO
2-+6H
2O=4Al(OH)
3↓.
点评:本题以无机框图题的形式考查Al、Cl等元素单质及其化合物之间的相互转化关系和逻辑推理能力、化学用语的书写、盐类水解等,本题中A、I的状态与性质用途、H的颜色与摩尔质量等均为解题突破口,推出A、I、H后,结合转化关系运用顺推法与逆推法进行推理,对学生的逻辑推理能力提出较高要求.

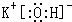 ;试剂X为硝酸银溶液;
;试剂X为硝酸银溶液;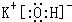 ;硝酸银溶液;4OH-+Al3+=AlO2-+2H2O;
;硝酸银溶液;4OH-+Al3+=AlO2-+2H2O;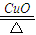 2KCl+3O2↑;
2KCl+3O2↑;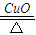 2KCl+3O2↑;分子晶体、离子晶体;
2KCl+3O2↑;分子晶体、离子晶体;

 通城学典默写能手系列答案
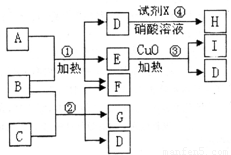
通城学典默写能手系列答案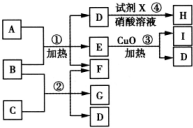 现有五种1~20号元素组成的A~I物质(试剂X、H除外),转化关系如图所示:
现有五种1~20号元素组成的A~I物质(试剂X、H除外),转化关系如图所示: 现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下
现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下

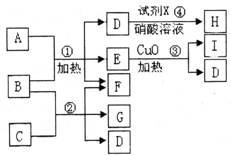 现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下
现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下