
| A. | CO的还原性强于Pd | |
| B. | 反应中PdCl2被氧化 | |
| C. | 若反应生成22.4 L CO2,则转移电子的物质的量一定为2 mol | |
| D. | CO气体只有在高温下才能表现出还原性 |
分析 CO+PdCl2+H2O=CO2+Pd↓+2HCl中,C元素的化合价由+2价升高为+4价,Pb元素的化合价由+2降低为0,结合元素化合价的变化解答该题.
解答 解:CO+PdCl2+H2O=CO2+Pd↓+2HCl中,C元素的化合价由+2价升高为+4价,Pb元素的化合价由+2降低为0,
A.反应中PdCl2为氧化剂,CO为还原剂,则还原性:CO>Pd,故A正确;
B.Pb元素的化合价由+2降低为0,反应中PbCl2被还原,故B错误;
C.没有指明标准状况下,无法计算,故C错误;
D.常温下CO能作还原剂,体现还原性,故D错误.
故选A.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,明确反应中元素的化合价变化及基本概念即可解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
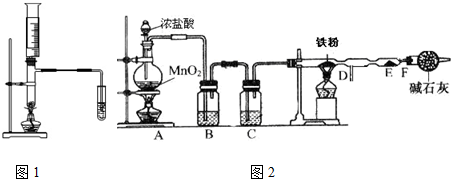
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25mL碱式滴定管量取20.00mL KMnO4溶液 | |
| B. | 用pH试纸测得Ca(ClO)2溶液的pH为10 | |
| C. | 用托盘天平称取20.00 g NaOH固体 | |
| D. | 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的$\frac{2}{3}$,液体也不能蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛溶液与新制氢氧化铜悬浊液共热CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+2H2O | |
| B. | 甲酸溶液与新制氢氧化铜反应:2H++Cu(OH)2→Cu2++2H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳: +CO2+H2O$\stackrel{△}{→}$ +CO2+H2O$\stackrel{△}{→}$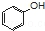 +HCO3- +HCO3- | |
| D. | 乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+OH-→CH3COO-+CH3CH2O-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
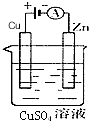 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa、25℃时,16gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ.N2H4完全燃烧反应的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol.
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa、25℃时,16gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ.N2H4完全燃烧反应的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这是一种矿物胶,既不燃烧也不受腐蚀 | |
| B. | 在建筑工业上可以作黏合剂、耐酸水泥掺料 | |
| C. | 木材、织物浸过水玻璃后具有防腐性能且不易燃烧 | |
| D. | 水玻璃的化学性质稳定,在空气中不易变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com