
【题目】下列说法不正确的是( )
A. NH4+中质子数和电子数相等 B. 乙醇比乙二醇的沸点低
C. 乙炔与苯的实验式均为 CH D. 过氧化钠与过氧化氢中均含有非极性键
科目:高中化学 来源: 题型:
【题目】如图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d 为两个电极。下列有关的判断不正确的

A. c 为负极,发生氧化反应
B. 电池工作的过程中,d 电极上产生气泡
C. 电池工作时,溶液中 SO42-向 d 移动
D. 电池工作的过程中,溶液中 SO42-浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与氢气完全加成后,不可能生成2,2,3-三甲基戊烷的烃是
A. (CH3)3 C—CH=CH2B. CH2=C(CH2CH3)C (CH3)3
C. HC≡CCH(CH3)C(CH3)3D. (CH3)3CC(CH3)=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的化学键既有极性键又有非极性键的是( )
A. CH3COONH4 B. Cl2 C. NH3 D. N2H4(分子中各原子均达到稳定结构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)假设元素周期表可以发展到第八周期,而且电子仍按照构造原理填入能级,第八周期应为_____种元素。
(2)已知N-N、N=N和N≡N键能之比为1.00:2.17:4.90,而C-C、C=C、C≡C键能之比为1.00:1.77:2.34.如何用这些数据理解氮分子不容易发生加成反应而乙炔容易发生加成反应?___
(3)下图是两种具有相同分子式的有机物——邻羟基苯甲酸和对羟基苯甲酸的结构简式。已知它的沸点相差很大,其中对羟基苯甲酸沸点较高,如何从氢键的角度来解释?_______
邻羟基苯甲酸 对羟基苯甲酸
对羟基苯甲酸
(4)离子晶体如食盐,很脆,经不起锤击;原子晶体如石英,同样很脆,也经不起锤击。然而食盐和石英的摩氏硬度却相差极大,应如何解释?____________________________________
(5)如图依次是金属钠、金属锌、碘、金刚石晶胞的示意图,

i:上图的碘晶体中碘分子的排列有____种不同取向,晶胞平均含_______个原子。
ii:金属锌晶胞参数依次为:a=266.49 pm,b=266.49 pm,c=494.68 pm,α=90°,β=90°,γ=120°,则该晶胞的底面积为 ___________cm2.。(只列式不计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为 M 的气态化合物V L(标准状况),溶于m g 水中, 得到质量分数为 w、物质的量浓度为c mol/L、密度为ρg/mL 的溶液,下列说法正确的是( )
A. 溶液密度![]() B. 物质的量浓度
B. 物质的量浓度![]()
C. 溶液的质量分数![]() D. 相对分子质量
D. 相对分子质量![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)在700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2 > t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2 > t1):
反应时间/min | 0 | t1 | t2 |
n(CO)/mol | 1.20 | 0.80 | 0.80 |
①反应在t1min内的平均速率:v(H2)=____mol·L-1·min-1。
②t2时刻,该反应的正反应速率___逆反应速率(填“大于”、“小于”或“等于”)。
(2)氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。
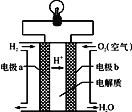
①该电池供电时,____能转化为____能。
②写出该电池供电时的总反应方程式________。
③电极b上发生______反应(“氧化”或“还原”)。
④在外电路中,电子流动的方向为________。
(3)镁铝合金(Mg17Al10)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al10+17H2=17MgH2+10Al。得到的混合物Y(17MgH2+10Al)在一定条件下可释放出氢气。
①镁铝合金的熔点比金属镁的熔点______。(填“高”或“低”)
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al10完全吸氢后得到的混合物Y与足量上述盐酸完全反应,释放出H2的物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知95 ℃时水的离子积KW=1×10-12,25 ℃时KW=1×10-14,回答下列问题:
(1)95 ℃时水的电离常数K(95 ℃)________25 ℃时水的电离常数(填“>”、“=”或“<”)。
(2)95 ℃纯水中c(H+)________c(OH-)。(填“>”、“=”或“<”)
(3)95 ℃时向纯水中加入NaOH,c(OH-)=1×10-1 mol/L,此时pH=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com