
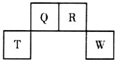
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )| A. | Q与W的原子能形成非极性分子 | |
| B. | T的离子半径大于W的离子半径 | |
| C. | RHn在同族元素的气态氢化物中沸点最低 | |
| D. | 在R的最高价氧化物对应水化物的浓溶液中单质T不溶解,说明未发生化学反应 |
分析 由短周期元素位置可知,Q、R处于第二周期,T、W处于第三周期,W的原子核内质子数与核外最外层电子数之比为8:3,最外层电子数为6,质子数为16,故W为S元素,可推知T为Al、Q为C、R为N,结合元素周期律与元素化合物性质解答.
解答 解:由短周期元素位置可知,Q、R处于第二周期,T、W处于第三周期,W的原子核内质子数与核外最外层电子数之比为8:3,最外层电子数为6,质子数为16,故W为S元素,可推知T为Al、Q为C、R为N,
A.Q与W的原子能形成CS2,结构式为S=C=S,为非极性分子,故A正确;
B.电子层越多,离子半径越大,则T的离子半径小于W的离子半径,故B错误;
C.氨气分子间含氢键,则RHn在同族元素的气态氢化物中沸点最高,故C错误;
D.R的最高价氧化物对应水化物的浓溶液中单质T不溶解,因常温下Al遇浓硝酸发生钝化,发生了氧化还原反应,故D错误;
故选A.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意W为元素推断的突破口,题目难度不大.


科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A.1 molN2与4 mol H2反应生成的NH3分子数为2NA
B.2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA
C.标准状况下,2.24L的CCl4中含有的C—Cl键数为0.4NA
D.标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
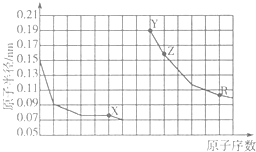
| A. | X、R的最简单氢化物的稳定性:X<R | |
| B. | X、Y、Z形成简单离子的半径大小:X>Y>Z | |
| C. | X、Y形成的化合物中只含有离子键 | |
| D. | Z单质着火可以用干冰进行灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g H218O中含有的中子数为NA | |
| B. | 1mol Fe与足量的浓硫酸反应,生成SO2的分子数为NA | |
| C. | 7.1g Cl2溶于水所得溶液中含有的Cl-数目为0.1NA | |
| D. | 丙烷燃料电池负极消耗2.24L(标准状况)气体时,电路中转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.595g | B. | 1.42g | C. | 2.485g | D. | 2.72g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
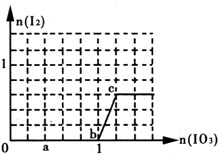
| A. | a点时消耗NaHSO3的物质的量为1.2 mol,得到的氧化产物为SO42- | |
| B. | b~c段的反应可用如下离子方程式表示:IO3-+5 I-+6H+═3I2+3H2O | |
| C. | 滴加过程中水的电离平衡一直逆向移动 | |
| D. | 从c点后所得混合液中分离出碘的操作为:加四氯化碳萃取分液,然后蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com