


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
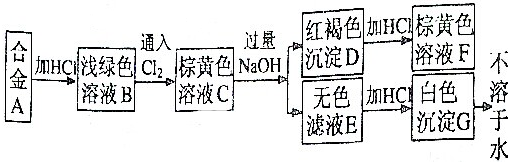
 利用如图所示装置收集以下8种气体(图中试管的位置不得变化):
利用如图所示装置收集以下8种气体(图中试管的位置不得变化):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 现需配制0.1mol/LNaOH溶液480mL,如图是某同学转移溶液的示意图.
现需配制0.1mol/LNaOH溶液480mL,如图是某同学转移溶液的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:
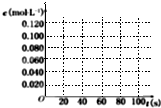 已知:N2O4(g)=2NO2(g);△H=+57.20kJ?mol-1.
已知:N2O4(g)=2NO2(g);△H=+57.20kJ?mol-1.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol/L | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol/L | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉的有效成分是Ca(ClO)2和CaCl2 |
| B、漂白粉在空气中久置后会变质 |
| C、漂白粉的有效成分CaCl2 |
| D、漂白粉的主要成分是CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 图为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答:
图为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com