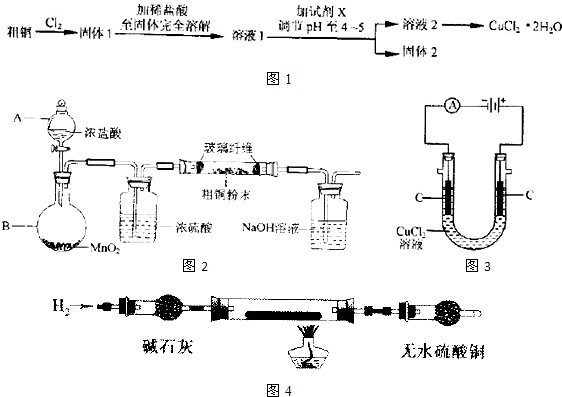
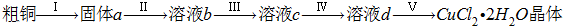解:(1)①仪器A是分液漏斗,故答案为:分液漏斗;
②制备气体,应首先检验装置的气密性,故答案为:检验装置气密性;
③HCl对反应没有影响,不需要在浓硫酸洗气瓶前增加吸收HCl的装置,故答案为:否;HCl不影响氯气和粗铜的反应的产物;
④反应后尾气含有氯气,不能直接排放到空气中,应用NaOH溶液进行尾气的吸收,如图
,故答案为:
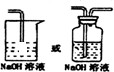
;
(2)步骤②为固体溶解的操作,操作方法为取固体1于烧杯中,加入适量稀盐酸,用玻璃棒搅拌至固体全部溶解,
故答案为:取固体1于烧杯中,加入适量稀盐酸,用玻璃棒搅拌至固体全部溶解;
(3)步骤③目的是调节溶液pH,使FeCl
3发生水解生成Fe(OH)
3沉淀而除去,则加入的物质应不能引入新杂质,可为Cu
2(OH)
2CO
3、CuO、CuCO
3等物质,发生反应的离子方程式为Cu
2(OH)
2CO
3+4H
+=2Cu
2++3H
2O+CO
2↑,从溶液中分离出固体,应用过滤的方法,
故答案为:c;Cu
2(OH)
2CO
3+4H
+=2Cu
2++3H
2O+CO
2↑;过滤;
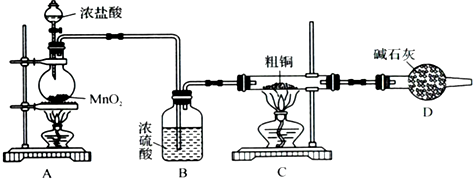
(4)a.将Y稀释,平衡向左反应移动,溶液呈蓝色,可以能够证明CuCl
2溶液中转化关系,故a正确;
b.在Y中加入CuCl
2晶体,溶液中Cu(H
2O)
42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl
2溶液中转化关系,故b正确;
c.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl
2溶液中转化关系,故c正确;
d.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl
2溶液中转化关系,故d错误.
故答案为:abc.
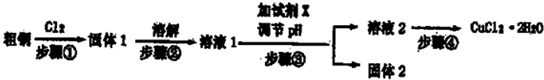
分析:粗铜中含有Fe,与氯气反应生成CuCl
2和FeCl
3,步骤③目的是调节溶液pH,使FeCl
3发生水解生成Fe(OH)
3沉淀而除去,则加入的物质应不能引入新杂质,可为Cu
2(OH)
2CO
3、CuO、CuCO
3等物质,得到的溶液2为溶液CuCl
2,经蒸发浓缩,冷却结晶可得到CuCl
2晶体;实验室用二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水,反应离子方程式为MnO
2+4H
++2Cl
-
Mn
2++Cl
2↑+2H
2O,含有HCl、H
2O等杂质,必须经过除杂,以此解答该题.
点评:本题考查考查较为综合,涉及物质的制备、检验和性质实验设计等问题,侧重于考查学生综合运用化学知识的能力,为高考常见题型,难度中等.

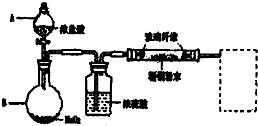
 ,故答案为:
,故答案为: ;
; Mn2++Cl2↑+2H2O,含有HCl、H2O等杂质,必须经过除杂,以此解答该题.
Mn2++Cl2↑+2H2O,含有HCl、H2O等杂质,必须经过除杂,以此解答该题.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案