
| A. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l);△H=-725.8kJ•mol-1 | |
| B. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l);△H=+1451.6kJ•mol-1 | |
| C. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l);△H=-22.68kJ•mol-1 | |
| D. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g);△H=-725.8kJ•mol-1 |
分析 1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则32g甲醇即1mol甲醇燃烧放的热量为725.8kJ,热化学方程式为CH4O(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ•mol-1或2CH4O(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ/mol.
解答 解:A、1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则32g甲醇即1mol甲醇燃烧放的热量为725.8kJ,热化学方程式为CH4O(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ•mol-1,故A正确;
B、甲醇的燃烧为放热反应,热化学方程式为2CH4O(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ/mol,故B错误;
C、甲醇的燃烧为放热反应,热化学方程式为2CH4O(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ/mol,故C错误;
D、1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则32g甲醇即1mol甲醇燃烧放的热量为725.8kJ,生成的水为液态,热化学方程式为CH4O(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ•mol-1,故D错误;
故选A.
点评 本题主要考查学生热化学方程式的书写方法及系数的含义,难度不大,注意焓变的正负和单位、物质的状态等问题,该题型是考试的热点.


科目:高中化学 来源: 题型:选择题
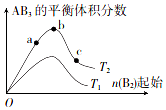 在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)?2AB3(g)的化学平衡状态的影响如图所示(T表示温度,n表示物质的量).下列判断正确的是( )
在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)?2AB3(g)的化学平衡状态的影响如图所示(T表示温度,n表示物质的量).下列判断正确的是( )| A. | 反应速率:a>b>c | B. | 达到平衡时A的转化率大小:b>a>c | ||
| C. | 若T2>T1.则正反应一定是吸热反应 | D. | 达到平衡时,n( AB3)的大小:b>a>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
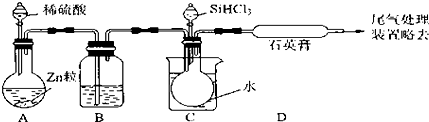
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
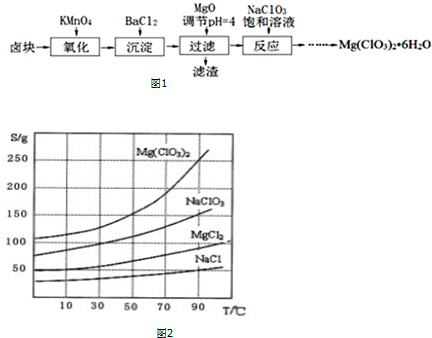
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
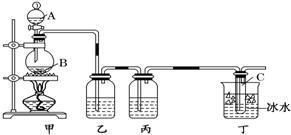
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com