
下列各组物项相互混合进行反应,既有气体生成最终又有沉淀生成的是( )
① 金属钠投入FeCl2溶液中
② 过量的NaOH溶液和明矾溶液反应
③ 少量CaO投入过量的NaHCO3溶液中
④ Na2O2投入到CuSO4溶液中
A. ①③ B. ③④ C. ①④ D. ②③
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源:2016-2017学年广西省高一上9月月考化学试卷(解析版) 题型:填空题
完成以下的填空
(1)现有1mol/LCaCl2溶液0.5L,Ca2+所具有的物质的量为____________,Cl-的物质的量浓度为___________
(2)标准状况下,33.6L的HCl所具有的物质的量为_____________,将其溶解于水配成3L的溶液,所得盐酸的物质的量浓度为__________.
(3)8gNaOH溶于_________g水中,才能使每10个水分子中溶有一个钠离子
(4)49gH2SO4中含__________mol原子,含__________个质子
(5)标准状况下,2.4g某气体的体积为672mL,则此气体的相对分子质量为_________
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第二次月考化学试卷(解析版) 题型:选择题
某溶液中含有HCO 、CO
、CO 、SO
、SO 、Na+、NO
、Na+、NO 五种离子。若向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是 ( )
五种离子。若向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是 ( )
A.SO 、NO
、NO B.CO
B.CO 、NO
、NO
C.NO D.CO
D.CO 、NO
、NO 、Na+
、Na+
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上学期第一次模拟化学试卷(解析版) 题型:选择题
已知反应:①Cl2+2KBr=2KCl+Br2
②KClO3+6HCl=3Cl2+KCl+3H2O
③2KBrO3+Cl2=Br2+2KClO3,下列说法正确的是()
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱的顺序为:KBrO3 > KClO3 > Cl2 > Br2
C.反应②中还原剂与氧化剂的物质的量之比为6∶1
D.③中1 mol Cl2反应则氧化剂得电子的物质的量为2 mol
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上学期第一次模拟化学试卷(解析版) 题型:选择题
下列有关实验操作、现象和解释或结论都正确的是( )
选项 | 操作 | 现象 | 解释或结论 |
A | Fe(OH )3 胶体通电后 | 阴极区红褐色加深 | Fe(OH)3胶体带正电 |
B | Al箔插入稀HNO3中 | 无现象 | Al箔表面被稀HNO3 氧化,形成致密的氧化膜 |
C | 将过量的过氧化钠投入 滴有酚酞试液的水中 | 最终得红色溶液 | 过氧化钠与水反应生成碱性物质 |
D | 将镁粉和铝粉的混合物加 入过量的烧碱溶液中 | 仍有未溶解粉末 | 铝粉能与烧碱溶液反应,而镁粉不反应 |
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上学期第一次模拟化学试卷(解析版) 题型:选择题
下列叙述不正确的是( )
A. 雾是气溶胶,在阳光下可观察到丁达尔效应
B. 欲制备Fe(OH)3胶体,向盛有沸水的烧杯中加入FeCl3饱和溶液煮沸得红褐色沉淀
C. 用石膏或卤水点制豆腐利用了胶体的性质
D. 用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期10月月考化学试卷(解析版) 题型:推断题
五种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
阳离子 | Na+ | Al3+ | Fe3+ | Cu2+ | Ba2+ |
阴离子 | OH- | Cl- | CO32- | NO3- | SO42- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片 不溶解,再滴加1.6 mol/L稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
不溶解,再滴加1.6 mol/L稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A的化学式为:A ;
(2)写出步骤②中发生反应的离子方程式 。
(3)D溶液中滴入石蕊试液,现象是 ,原因是 (用离子方程式说明)。
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是 mL。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第一次月考化学试卷(解析版) 题型:实验题
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2C r2O7)的工艺如下(部分操作和条件略):
r2O7)的工艺如下(部分操作和条件略):
Ⅰ.将铬铁矿和碳酸钠混合充分焙烧。
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A。
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B。
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5。
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体。
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
FeO•Cr2O3 + Na2CO3 +  Na2CrO4 + Fe2O3 + CO2↑;
Na2CrO4 + Fe2O3 + CO2↑;
②Na2CO3+Al2O3=2NaAlO2+CO2↑。
(2)固体A中主要含有 (填写化学式)。
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+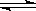 Cr2O72-+H2O。Ⅳ中调节溶液pH<5时,其目的是 。
Cr2O72-+H2O。Ⅳ中调节溶液pH<5时,其目的是 。
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知下表数据
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度 (g/100g水) | 0℃ | 28[来 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
①该反应能发生的理由是 。
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、 、 、过滤、洗涤、干燥得到晶体。
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量________(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g。计算样品中氢氧化铝的质量分数为______ (用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上10月月考化学卷(解析版) 题型:选择题
相同状况下,20mL气体A2和10mL气体B2恰好化合生成20mL气体C,则C的化学式为
A.AB B.AB2
C.A2B D.A4B2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com