
| A. | 乙烯在空气中燃烧时有黑烟,因此可以用燃烧法区别甲烷和乙烯 | |
| B. | 苯与浓硝酸在浓硫酸存在条件下加热发生取代反应 | |
| C. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性 | |
| D. | 氨基酸能够以不同数目和顺序相结合形成结构复杂的多肽 |
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:实验题
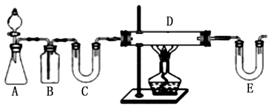

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 块状固体药品的取用:一横、二放、三慢竖 | |
| B. | 液体药品的倾倒:瓶塞倒放、紧挨瓶口、缓慢倒入 | |
| C. | 分液的操作:静置分层后将分液漏斗中下层液从下口放出,再将上层液从上口倒出 | |
| D. | 冷凝管的使用:冷却水下口进,上口出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
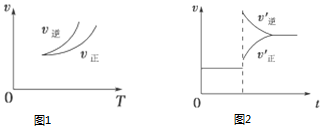
| A. | 图1说明正反应为吸热反应 | |
| B. | 反应达平衡后,增大压强气体密度将减小 | |
| C. | 图2可表示升高温度使平衡向逆反应方向移动 | |
| D. | 图2虚线可表示使用催化剂后引发的反应速率变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 置换反应 | C. | 氧化还原反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定不含CH4和H2,可能含有NO2和NH3 | |
| B. | 一定含有CO,可能含HCl和CO2 | |
| C. | 只含有CO和HCl | |
| D. | 一定含CO和HCl,可能含CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

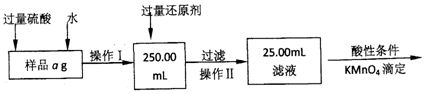
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | O═O | C≡O | C═O |
| 键能(kJ/mol) | 497 | 1072 | 803 |

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com