
某温度时容积为2 L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示,则:

(1)计算反应开始2 min内的v(X)、v(Y)、v(Z)。
(2)写出该反应的化学方程式。
(1)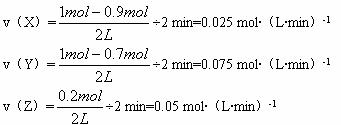
(2)该反应的化学方程式是X+3Y=2Z。
由图中可以看出:X、Y物质的量从开始时的1.0 mol 分别减少到2 min末的0.9 mol 和0.7 mol,所以X和Y是反应物,而Z的物质的量则从开始时的0增大到2 min末的0.2 mol,故Z是生成物。由化学反应速率的定义应计算各物质的浓度和浓度的变化值。
解:(1) X Y Z
起始浓度(mol·L-1) ![]()
![]() 0
0
2 min末浓度(mol·L-1) ![]()
![]()
![]()
2 min内浓度变化(mol·L-1) 减少![]() 减少
减少![]() 增加
增加![]()
所以,
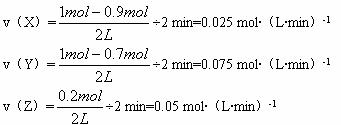
(2)v(X)∶v(Y)∶v(Z)=0.025∶0.075∶0.05=1∶3∶2,即化学方程式中X、Y、Z的化学计量数之比是1∶3∶2,所以该反应的化学方程式是X+3Y=2Z。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源:上海市凤城高中2009届高三寒假模拟考试、化学试题 题型:022
现有下列物质:
①Cl2 ②SO2 ③0.1 mol·L-1 Na2CO3 ④0.1 mol·L-1 NH3H2O ⑤0.1 mol·L-1 CH3COOH ⑥BaSO4
(1)属于强电解质________属于弱电解质________属于非电解质________,向⑤中加入等物质的量④,溶液导电性________(填“增强”或“减弱”)
(2)已知③溶液呈碱性,甲同学认为显碱性原因是CO32-水解所致,为证明上述观点是否正确,请设计一个简单的实验,简述实验过程.________________.
(3)同学乙认为③溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%.请你设计实验证明该同学的观点是否正确.________________.
(4)在T℃时,反应2SO2(g)+O2(g) 2SO3(g)ΔH<0的平衡常数K=6×102则:
①温度升高,化学平衡移动后,平衡常数K值________(填“增大”、“减少”或“不变”).
②T℃时,某生向容积为2 L的密闭容器中充入0.4 mol SO2、0.18 mol O2和1.2 mol SO3的混合气体,此时该反应是否处于化学平衡状态________(填“是”或“否”),化学反应速率V(正)________V(逆)(填“大于”、“等于”或“小于”).
查看答案和解析>>
科目:高中化学 来源: 题型:

图2-6
(1)计算反应开始2 min内的v(X)、v(Y)、v(Z)。
(2)写出该反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三上学期10月份月考化学试卷 题型:实验题
(15分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。
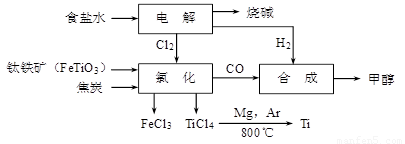
请填写下列空白:
⑴写出钛铁矿经氯化得到四氯化钛的化学方程式: ▲ 。
⑵由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。[来源:]
CH3OH(g)。[来源:]
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 ▲ (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②若不考虑生产过程中物质的任何损失,该产业链中每合成19.2 t甲醇,至少需额外补充H2 ▲ t。
⑶用甲醇-空气碱性(KOH)燃料电池作电源电解精炼粗铜(右图),
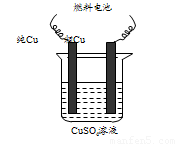
在接通电路一段时间后纯Cu质量增加6.4 g。
①请写出燃料电池中的负极反应式: ▲ 。
②燃料电池正极消耗空气的体积是 ▲ (标准状况,空气中O2体积分数以20%计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业和交通运输业的迅速发展,机动车数量的日益增多,人类向大气中大量排放烟尘和S02等有害气体等,对大气造成了严重的污染。一研究性学习小组对某市的空气污染情况和SO2参与的反应进行了研究。
(1)空气污染易形成酸雨。从环境保护的角度认为:雨水的pH<5.6时,就判断为酸m。,
该小组同学测定某次雨水中只含硫酸,且浓度为5×10-5mol.L,这次降雨 (填是或不是)酸雨。
(2)该小组同学欲测定空气(含氮气、氧气、 二氧化碳、 二氧化硫等)中,SO2,的体积百分含量(标况),请利用溴水、BaCl2溶液及必要的实验仪器设计实验方案,写出简要的实骤 。
上述实验过程中发生反应的离子方程式为 ,其中SO2参与的反应中,SO2显 性。
(3)在T℃时,反应![]() ‹0的平衡常数K=6×102,则
‹0的平衡常数K=6×102,则
①温度升高,化学平衡移动后,平衡常数K值 (填“增大”、“减少”或“不变”)。
②在T℃时,某生向容积为2 L的密闭容器中充入0.4 mol SO2、0.18 molO2和 1.2 mol SO3混合气体,此时该反应是否处于化学平衡状态 (填“是”或“否”),化学反应速率v(正)
v(逆)(填“大于”、“等于”或“小于”),你判断的依据是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com