
Ⅰ、工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质。为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,某温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0KJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示
CH3OH(g)+H2O(g)△H=-49.0KJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示
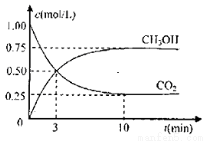
(1)该反应该温度下,化学平衡常数的值为_______________________
(2)下列说法中能作为反应达到平衡状态标志的是___________________(填字母)。
A.容器内压强不再发生变化
B.平均相对分子质量不再变化
C.c(CO2)和c(H2)之比等于1:3
D.相同时间内每断裂3molH-H键,同时断裂3molO-H键
(3)下列措施中能使n(CH3OH)/n(CO2)减小的是__________________
A.再充入1molCO2和3molH2 B.将H2O(g)从体系中分离
C.充入He(g),使体系压强增大 D.升高温度
Ⅱ、钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题。
(1)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:

①A电极对应的金属是_________(写元素名称),B电极的电极反应式是__________;
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为__________;
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因___________________________。
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源:2015-2016学年吉林省高二上期末考试化学试卷(解析版) 题型:选择题
铜锌原电池(如图)工作时,下列叙述正确的是
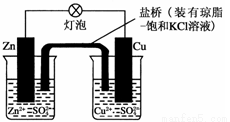
A.正极反应为:Zn-2e-=Zn2+
B.电池反应为:Zn+Cu2+=Zn2++Cu
C.当有1mol电子转移时,锌极减轻65g
D.盐桥中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测二化学试卷(解析版) 题型:选择题
下列实验误差分析正确的是
A、用湿润的pH试纸测稀碱液的pH,测定值偏大
B、用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D、测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏大
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测一化学试卷(解析版) 题型:选择题
纯净物X、Y、Z转化关系如右图所示,下列判断正确的是( )
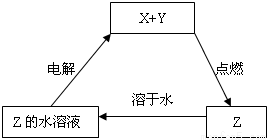
A.X可能是金属铜
B.Y不可能是氢气
C.Z可能是氯化钠
D.Z可能是三氧化硫
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上12月月考化学试卷(解析版) 题型:选择题
一般情况下,前者无法决定后者的是( )
A.原子核外电子排布﹣﹣元素在周期表中的位置
B.弱电解质的相对强弱﹣﹣电离常数的大小
C.分子间作用力的大小﹣﹣分子稳定性的高低
D.物质内部储存的能量﹣﹣化学反应的热效应
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上期末化学试卷(解析版) 题型:选择题
把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含bmolBaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸根,则原混合溶液中钾离子的浓度为( )
A.(b-a)/V mol•L-1 B.(2b-a)/V mol•L-1
C.2(b-a)/V mol•L-1 D.2(2b-a)/V mol•L-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一上期末考试化学试卷(解析版) 题型:选择题
常温下,下列溶液可以用铝槽车装运的是( )
A.氢氧化钠溶液 B.浓盐酸 C.浓硝酸 D.稀硝酸
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第二次质检化学试卷(解析版) 题型:推断题
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
元素 元素性质或原子结构
A 周期表中原子半径最小的元素
B 原子核外有三种不同的能级且各个能级所填充的电子数相同
C 最外层p轨道半充满
D 位于短周期,其原子的核外成对电子数是未成对电子数的3倍
E 位于ds区且原子的最外层电子数与A的相同
请回答下列问题(用A、B、C、D、E所对应的元素符号作答):
(1)B、C、D第一电离能由小到大为______________。
(2)E的二价离子的电子排布式为______________。
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为_______________;1 mol A2B2D4分子中含有σ键数目为____________。
(4)与化合物BD互为等电子体的阴离子化学式为________________(任写一种)。
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是__________________。
(6)BD2在高温高压下所形成晶体的晶胞如图所示。一个该晶胞中含______________个D原子。
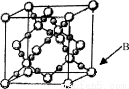
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com