
分析 (1)C2H8N2中的N元素的化合价由-3价升高为0,C元素的化合价由-1价升高为+4价,故一个C2H8N2参与反应化合价升高16,N2O4中的N元素化合价由+4价降低为0,故一个N2O4参与反应化合价降低8,结合电子守恒及质量守恒定律解答;
(2)N2O4是无色气体,可溶于水,且与水反应生成两种含氧酸,由反应物可知两种含氧酸必定都是含氮的含氧酸,再根据化合价变化书写化学方程式;
(3)依据盖斯定律结合已知热化学方程式计算并结合热化学方程式书写方法书写;该反应2N2H4+2NO2=3N2+4H2O中,2N2H4→2N2,N元素由-2价→0价,所以反应2molN2H4,转移8mol电子.
解答 解:(1)C2H8N2中的N元素的化合价由-3价升高为0,C元素的化合价由-1价升高为+4价,故一个C2H8N2参与反应化合价升高16,N2O4中的N元素化合价由+4价降低为0,故一个N2O4参与反应化合价降低8,结合电子守恒所以C2H8N2前为1,N2O4前为2,则氮气前为3二氧化碳前为2,最后根据原子守恒补上4个水,反应为C2H8N2+2N2O4=3N2↑+2CO2↑+4H2O↑,
故答案为:1;2;3; 2;4H2O;
(2)N2O4是无色气体,可溶于水,且与水反应生成两种含氧酸,由反应物可知两种含氧酸必定都是含氮的含氧酸,又N2O4的氮+4和水反应刚好一个升高到+5的硝酸,一个降低到+3的亚硝酸,故反应方程式为:N2O4+H2O=HNO3+HNO2;根据以上分析A.N2O4只做氧化剂错误,C.反应中水只做溶剂错误;B.产物中两种酸都是强酸,因为亚硝酸是弱酸也错误;D.N2O4泄漏后可产生红棕色气体,由于存在N2O4?2NO2平衡所以D正确;
故答案为:N2O4+H2O=HNO3+HNO2;D;
(3)①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ•mol-1;②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534KJ•mol-1
依据盖斯定律,②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
该反应2N2H4+2NO2=3N2+4H2O中,2N2H4→2N2,N元素由-2价→0价,所以反应2molN2H4,转移8mol电子,所以当该反应中转移0.8mol电子时,理论上消耗N2H4(g)在标准状况下0.2mol×22.4L/mol=4.48L,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;4.48.
点评 本题主要考查了氧化还原反应的方程式书写、计算,热化学方程式的书写等知识,题目难度中等,注意盖斯定律的应用.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol•L-1的NaCl | B. | 25mL 2mol•L-1的FeCl3 | ||
| C. | 150mL 3mol•L-1的KCl | D. | 75mL 2mol•L-1的CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
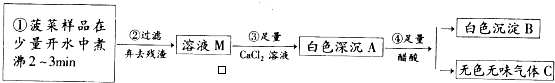
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
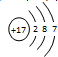 ,C的离子结构示意图
,C的离子结构示意图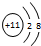 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com