
| A. | 苯 四氯化碳 | B. | 乙炔 乙烯 | C. | 乙烷 乙烯 | D. | 苯 酒精 |
科目:高中化学 来源: 题型:解答题

 ;
; 、
、 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①③⑤ | C. | ①②⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
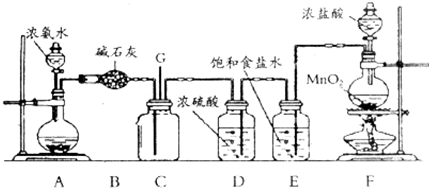
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
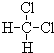 和
和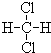 ;
;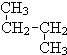 和
和 ⑦CH3 (CH2) 3CH3和
⑦CH3 (CH2) 3CH3和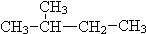
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉.在一定条件下,Ni可以与CO(g)发生如下反应:Ni(s)+4CO(g)$?_{453~473K}^{323~353K}$Ni(CO)4(g)
如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉.在一定条件下,Ni可以与CO(g)发生如下反应:Ni(s)+4CO(g)$?_{453~473K}^{323~353K}$Ni(CO)4(g)| A. | 在石英管右端主要物质是Ni(CO)4(g) | |
| B. | 在石英管右端主要物质是纯Ni(s)和CO(g) | |
| C. | 在石英管左端主要物质是纯Ni(s)和CO(g) | |
| D. | 整个过程可以看作CO(g)将Ni(s)从石英管左端转移到右端,从而达到提纯目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
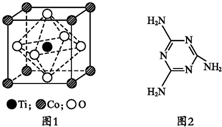 MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com