
某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。

请回答下列问题。
(1) 图中涉及分离溶液与沉淀的方法是__________________。
(2) B、C、D、E 4种物质的化学式为:B_________、C_________、D_________、E_________。
(3)沉淀F与NaOH溶液反应的离子方程式为
沉淀E与稀硫酸反应的离子方程式为
溶液G与过量稀氨水反应的化学方程式为
科目:高中化学 来源:2016届吉林省高三上期末考试化学试卷(解析版) 题型:填空题
下列各表述与示意图不一致的是
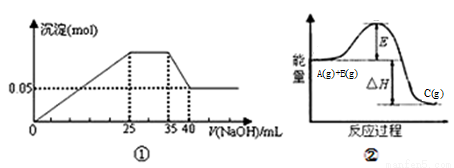
(1)图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的物质的量和NaOH的体积的关系图。则三种离子的物质的量之比为______________________;
图②中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C时,△H____0,若使用正催化剂,E值会_____________(增大、减小、不变)。
(2)在Cu2O/ZnO做催化剂的条件下,将CO(g)和H2O(g)充入容积为2L的密闭容器中合成CH3OH(g) ,反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图.根据题意回答下列问题:
①反应达到平衡时,平衡常数表达式K=______________;升高温度,K值____________(填“增大”、“减小”或“不变”).
②在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= ____________;
③若其它条件不变,对处于Z点的体系,将体积压缩至原来的 1/2,达到新的平衡后,下列有关该体系的说法正确的是_________;
a.氢气的浓度与原平衡比减少 b.正、逆反应速率都加快
c.甲醇的物质的量增加 d.重新平衡时n(H2) /n(CH3OH)增大
④据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是_________________;(写出相关的化学方程式并辅以必要的文字说明).
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测一化学试卷(解析版) 题型:选择题
下列物质见光不会分解的是( )
A.HClO B.NH4Cl C.HNO3 D.AgNO3
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上期末化学试卷(解析版) 题型:选择题
某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成.
②另取少量原溶液,逐滴加入5mL0.2mol•L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量 基本不变后产生气体,最后沉淀逐渐减少至消失.
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43g.
下列说法中正确的是( )
A.该溶液中一定不含Ba2+、Mg2+、A13+、SiO32-、Cl-
B.该溶液中一定含有K+、AlO2-、CO32-、Cl-
C.该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片)
D.可能含有Cl-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上期末考试化学试卷(解析版) 题型:简答题
有可逆反应Fe(s)+CO2(g)  FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是 (双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了 C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_____________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式______________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=______________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。

①升高温度________________;②再通入CO_________________。
(5)该反应的逆反应速率随时间变化的关系如图:
①从图中看到,反应在t2时达平衡, 在t1时改变了某种条件,改变的条件可能是(填序号)
__ ___。(单选)
A.升温 B.增大CO2浓度
②如果在t3时从混合物中分离出部分CO,t4~ t5时间段反应处于新平衡状态,请在图上画出t3~ t5的V(逆)变化曲线
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期末考试化学试卷(解析版) 题型:选择题
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品氧化变质,在包装袋中可以放入的化学物质是 ( )
A.无水硫酸铜 B.硫酸亚铁 C. 食盐 D. 生石灰
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一上期末考试化学试卷(解析版) 题型:选择题
下列变化中,属于化学变化的是( )
A.焰色反应 B.碘的升华 C.液溴的挥发 D.淀粉遇碘变蓝
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学试卷(解析版) 题型:选择题
一定温度下,AgCl在相同体积的下列液体中溶解量最大的是( )
A.纯水 B.0.1mol/L的HCl C.0.1mol/L的MgCl2 D.0.1mol/L的AgNO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁任城区高二上学期统考化学试卷(解析版) 题型:选择题
已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol下列结论正确的是
A.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
B.①的反应热为221kJ/mol
C.通过浓硫酸与稀NaOH溶液反应测得的中和热为57.3kJ/mol
D.碳的燃烧热的数值大于110.5kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com