
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:阅读理解
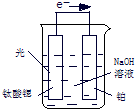 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.| 1 |
| 2 |
c(H2)c
| ||
| c(H2O) |
c(H2)c
| ||
| c(H2O) |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2015届山东省临沂市高二上学期期中考试化学试卷(解析版) 题型:选择题
某温度下,X(g)+Y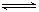 2Z反应达到平衡,在升高温度或减小压强的情况下,平衡均向右移动,则下列有关反应的各种叙述中正确的是
2Z反应达到平衡,在升高温度或减小压强的情况下,平衡均向右移动,则下列有关反应的各种叙述中正确的是
A.正反应是吸热反应,Z是固体
B.逆反应是放热反应,Y是固体,Z为气体
C.正反应是吸热反应,只有Z不是气体
D.正反应是放热反应,Y和Z均为气体
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.正反应是吸热反应,Z是固体 |
| B.逆反应是放热反应,Y是固体,Z为气体 |
| C.正反应是吸热反应,只有Z不是气体 |
| D.正反应是放热反应,Y和Z均为气体 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年云南省西双版纳州景洪四中高二(上)期中化学试卷(理科)(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com