
| A. | 若8>m>3,则X必定为主族元素 | |
| B. | 若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为极性分子 | |
| C. | 若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y>X | |
| D. | 若a=b=3,8>m>n>b,则元素非金属性:X>Y |
分析 A.若8>m>3,则X处于ⅢA~ⅦA族;
B.若Y的气态氢化物化学式为YHn,且b<4,可以是处于ⅣA族的CH4;
C.若a<b<m=n=4,二者处于ⅣA族,X为C元素、Y为Si,都形成原子晶体,共价键越短,熔沸点越高;
D.若a=b=3,8>m>n>b,两种元素位于相同周期,且X原子序数较大,同周期元素从左到右,元素的非金属性逐渐增强.
解答 解:A.若8>m>3,则X一定处于ⅢA~ⅦA族,故A正确;
B.若Y的气态氢化物化学式为YHn,且b<4,可以处于ⅣA族,其氢化物为CH4,CH4为正四面体结构,分子中正负电荷中心重合,属于非极性分子,故B错误;
C.若a<b<m=n=4,二者处于ⅣA族,X为C元素、Y为Si,都形成原子晶体,金刚石中C-C键的键长<晶体Si中Si-Si,故C-C键更稳定,熔沸点:晶体硅<金刚石,故C错误;
D.若a=b=3,8>m>n>b,两种元素位于第三周期,且X原子序数较大,同周期元素从左到右,元素的非金属性逐渐增强,故则元素非金属性:X>Y,故D正确,
故选BC.
点评 本题考查结构性质位置关系、分子结构与性质、晶体类型与性质等知识,题目难度中等,确定元素在周期表中位置是关键,注意元素的不确定性,试题培养了学生的灵活应用能力.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:解答题
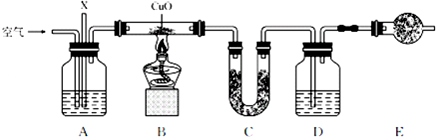
| 质量 | 实验前 | 实验后 |
| 药品+U形管的质量/g | 101.1 | 102.9 |
| 药品+广口瓶D的质量/g | 312.0 | 314.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
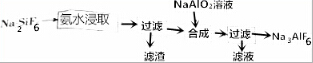
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L的NO2和CO2混合气体含有2NA个O原子 | |
| B. | 常温常压下,18gH2O中含有的原子总数为3NA | |
| C. | 标准状况下,11.2LCH3CH2OH中含有的分子数目为0.5NA | |
| D. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用广泛pH试纸测得 0.1mol/L NH4Cl溶液的pH=5.2 | |
| B. | 酸碱中和滴定时锥形瓶用蒸馏水洗涤后,再用待测液润洗后装液进行滴定 | |
| C. | 将碘水倒入分液漏斗,加入适量苯振荡后静置,从分液漏斗放出碘的苯溶液 | |
| D. | 在溴化钠中加入少量的乙醇,再加入2倍于乙醇的1﹕1的硫酸制取溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时铅蓄电池负极电池反应 PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| B. | 充电时蓄电池阴极电极反应 PbSO4+2e-═Pb+SO42- | |
| C. | 用铅蓄电池来电解CuSO4溶液,要生成1.6g Cu,则该电池内部要消耗0.025mol H2SO4 | |
| D. | 铅蓄电池充电时,若要使3.03kg PbSO4转变为Pb和PbO2,则需要通过20mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
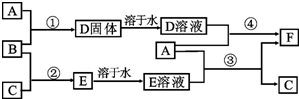 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示.
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com