
【题目】下列反应的离子方程式表示正确的是( )
A. 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
B. 铜片与浓硝酸:Cu+NO3-+4H+=Cu2++NO↑+2H2O
C. 氯化铵浓溶液跟浓NaOH溶液混合后加热:NH4++OH-![]() NH3·H2O
NH3·H2O
D. 将稀硫酸滴在Cu片上:Cu+2H+![]() Cu2++H2↑
Cu2++H2↑
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R 是五种短周期元素,原子序数依次增大。X、Y 两元素最高正价与最低负价之和均为 0;Q 与 X 同主族;Z、R 分别是地壳中含量最高的非金属元素和 金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)____________。
(2)X 与 Z 能形成多种化合物,请写出其中既含极性键又含非极性键的物质的分子式_______________。
(3)由以上某些元素组成的化合物 A、B、C、D 有如下转化关系:A![]() B其中,A、B、D 均由三种元素组成,B 为两性不溶物,C 是一种能造成温室效应的气体。D的电子式_____;由 A 与足量 C 反应转化为 B 的离子方程为_________;(4)Q的氢化物与Z的普通氢化物之间的化学反应方程式为:_________;
B其中,A、B、D 均由三种元素组成,B 为两性不溶物,C 是一种能造成温室效应的气体。D的电子式_____;由 A 与足量 C 反应转化为 B 的离子方程为_________;(4)Q的氢化物与Z的普通氢化物之间的化学反应方程式为:_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在一个小烧杯里加入研细的20g Ba(OH)2·8H2O晶体。将此小烧杯放在事先滴有3~4滴水的玻璃片上,然后向小烧杯中加入10g NH4Cl晶体,并用玻璃棒快速搅拌。
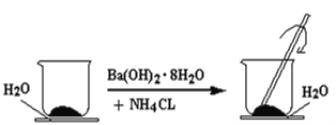
(1)实验中要用玻璃棒搅拌的原因是___________
(2)写出有关反应的化学方程式:________,该反应_______(填“是”或“不是”)氧化还原反应。
(3)该实验中观察到的现象除产生刺激性气味的气体及反应混合物呈糊状以外,还有__________。
(4)通过最后一个现象可以说明该反应为_____(填“吸”或“放”)热反应,这是由于反应物的总能量___(填“大于”或“小于”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料在日常生活、生产中有着广泛的运用,下列关于金属的说法中不正确的是( )
A.越活泼的金属越难冶炼
B.合金的性质与其成分金属的性质不完全相同
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.金属元素在自然界中都以化合态的形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】历史上最早应用的还原性染料是靛蓝,其结构简式如下,下列关于靛蓝的叙述中错误的是
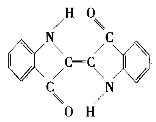
A. 该物质是高分子化合物
B. 靛蓝由碳、氢、氧、氮四种元素组成
C. 它的分子式是C16H10N2O2
D. 它是不饱和的有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: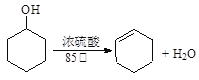 ;
;
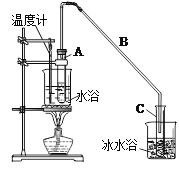
反应物和生成物的物理性质如下表:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | -103 | 83 | 难溶于水 |
制备粗品:将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 。
②试管C置于冰水浴中的目的是 。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入
饱和食盐水,振荡、静置、分层,环己烯在 层(填上
或下),分液后用 (填序号)洗涤:
a.KMnO4溶液 b.稀H2SO4c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从 (填字母)口进入;蒸馏时要加入生石灰的目的 。
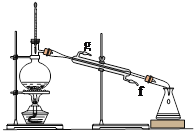
③上图蒸馏装置收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 :a.蒸馏时从70℃开始收集产品;b.环己醇实际用量多了;c.制备粗品时环己醇随产品一起蒸出;d.是可逆反应,反应物不能全部转化
(3)区分环己烯精品和粗品(是否含有反应物)的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见四种物质在一定条件下的转化关系(其他产物已略去)。根据所学知识,回答下列问题:

(1)若B、X都是气体单质,C遇空气变为红棕色气体,A遇湿润的红色石蕊试纸变蓝,A在纯氧气中点燃可生成单质B,则A是____。写出反应A→C的化学方程式_______
(2)若A是地壳中含量第二位的金属单质,X是一种常见最高价易挥发的含氧酸,常温下,发生如图转化关系,则X是____(填化学名称),B是____,写出反应A→C的离子方程式:______;C→B的离子方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学购买了一瓶“84消毒液”,包装说明如下,请根据以上信息和相关知识判断,下列分析不正确的是( )

A. 该“84消毒液”的物质的量浓度约为4.0 mol·L-1
B. 一瓶该“84消毒液”敞口放置一段时间后浓度会变小
C. 取100 mL该“84消毒液”稀释100倍用以消毒,稀释后溶液中c(Na+)约为0.04mol·L-1
D. 参阅该“84消毒液”的配方,欲用NaClO固体配制含25%NaClO的消毒液480 mL,需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,11.2 L水中含有的氢原子数为NA
B. 1 mol·L-1FeCl3溶液中,阳离子数为NA
C. 一定条件下,将1mol SO2和0.5 mol O2充入一密闭容器内,充分反应后的生成物分子数为NA
D. 在反应2Na2O2+2CO2![]() 2Na2CO3+O2中,每生成0.5 molO2转移的电子数为NA
2Na2CO3+O2中,每生成0.5 molO2转移的电子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com