
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度一定是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | pH=6的醋酸与醋酸钠的混合溶液中:c(Na+)>c(CH3COO-) | |
| C. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1 NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)═2c(H+)+c(CH3COOH) | |
| D. | pH=8的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
分析 A.溶液中一定满足电荷守恒,该关系c(Cl-)>c(NH4+)>c(OH-)>c(H+)违反的电荷守恒;
B.溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可知c(Na+)<c(CH3COO-);
C.反应后溶质为等浓度的醋酸、醋酸钠溶液,根据电荷守恒、物料守恒判断;
D.碳酸氢钠溶液的pH=8,说明碳酸氢根离子的电离程度小于其水解程度,则c(H2CO3)>c(CO32-).
解答 解:A.含有NH4+、Cl-、H+、OH-的溶液中一定满足电荷守恒,而离子浓度关系c(Cl-)>c(NH4+)>c(OH-)>c(H+)违反的电荷守恒,故A错误;
B.pH=6的溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可知c(Na+)<c(CH3COO-),故B错误;
C.将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1 NaOH溶液等体积混合,反应生成等浓度的醋酸和醋酸钠,根据物料守恒可得:2c(Na+)=c(CH3COO-)+c(CH3COOH),根据电荷守恒可知:c(OH-)+c(CH3COO-)═c(H+)+c(Na+),二者结合可得:2c(OH-)+c(CH3COO-)═2c(H+)+c(CH3COOH),故C正确;
D.pH=8的NaHCO3溶液,说明HCO3-的水解程度大于其电离程度,则c(H2CO3)>c(CO32-),溶液中正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、电荷守恒、物料守恒的含义为解答关键,C为易错点,正确判断反应后溶质组成为解答关键,试题培养了学生的分析能力及灵活应用能力.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,在制备乙醛的同时能获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法不正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,在制备乙醛的同时能获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法不正确的是( )| A. | 该电池可将化学能转化为电能 | |
| B. | 每有0.1 mol O2反应,则迁移0.4 mol H+ | |
| C. | 正极反应式为:CH2=CH2-2e-+2OH-═CH3CHO+H2O | |
| D. | 负极区溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即盖上盖板,用环形玻璃搅拌棒不断搅拌,准确读出反应体系的最高温度 | |
| B. | 实验事实证明乙酸乙酯中少量乙醇可以用水洗方法除去,其原理与溴水中加四氯化碳萃取溴类似 | |
| C. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度,加快油脂皂化反应速率 | |
| D. | 当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/LNaHCO3 溶液中有:c(Na+)>c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | 在NaHSO4溶液中有:c(Na+)=c(SO42-)=c(H+) | |
| C. | 在新制氯水中加入KOH至溶液呈中性,则溶液中有:c(K+)=2c(ClO-)+C(HClO) | |
| D. | 将等物质的量浓度的Na2SO3溶液和NaHSO4溶液等体积混合后的混合溶液中:c(OH-)-c(H2SO3)=c(H+)+c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
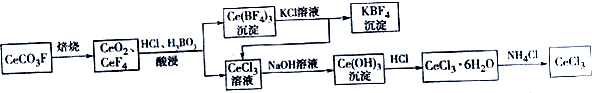
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3 | B. | SiO2 | C. | Fe2O3 | D. | MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯的结构式:C7H8 | B. | 乙烷的结构简式:CH3CH3 | ||
| C. | 甲醇的电子式:CH3OH | D. | 乙醇的分子式:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
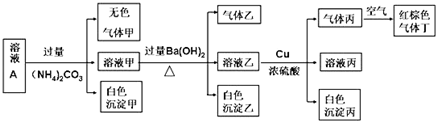
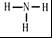 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH3在该反应中作还原剂,被氧化 | |
| B. | Si3N4具有硬度大、熔点高,说明Si3N4可用作耐高温材料 | |
| C. | 标准状况下,22.4LNH3所含原子总数目为4×6.02×1023 | |
| D. | 该反应每生成1mol Si3N4转移电子总数目为12×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com