


科目:高中化学 来源: 题型:
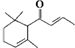 ,分子式为C13H20O,有关该化合物的下列说法正确的是( )
,分子式为C13H20O,有关该化合物的下列说法正确的是( )| A、该化合物可发生加聚反应 |
| B、该化合物可发生银镜反应 |
| C、1 mol该化合物完全燃烧消耗19 mol O2 |
| D、一定条件下1 mol该化合物最多可与3mol氢气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫具有漂白性,可广泛用于食品的增白 |
| B、可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
| C、碘是人体必须微量元素,所以食盐中常加入适量KIO3 |
| D、侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中碳原子不在一条直线上,呈锯齿形 |
| B、在光照条件下能够与氯气发生取代反应,生成的一氯丙烷有两种同分异构体 |
| C、丙烷比同系物丁烷易汽化,完全燃烧等物质的量的丙烷和丁烷时,丙烷耗氧量多 |
| D、燃烧时主要是将化学能转变为热能和光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
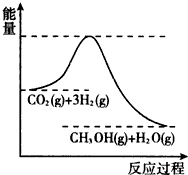
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com