
以下有关物质的质量分数和物质的量浓度的叙述正确的是()
A. 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成硫酸钡沉淀的质量相等,则三种硫酸盐溶液的物质的量浓度之比为1:1:1
B. Na2O2和Na2O各0.1mol分别放入100g水中,所得溶液的物质的量浓度不相等
C. 质量分数分别为5%和15%的氨水等体积混合后所得溶液的质量分数为10%
D. 20℃时,饱和KCl溶液的密度为1.174g•cm﹣3,物质的量浓度为4.0 mol•L﹣1,则此溶液中KCl的质量分数为 ×100%
×100%
考点: 溶液中溶质的质量分数及相关计算;物质的量浓度的相关计算.
专题: 物质的量浓度和溶解度专题.
分析: A.生成硫酸钡沉淀的质量相等,根据硫酸根离子的物质的量相等及三者的化学式组成计算出硫酸铁、硫酸铜、硫酸钾的浓度之比;
B.等物质的量的Na2O2与Na2O分别于水反应生成等物质的量的NaOH,消耗的水的量相同,生成的OH﹣浓度相同,所得溶液的浓度一定相等;
C.氨水密度小于1,质量分数分别为5%和15%的氨水等体积混合后得到的溶液质量分数小于两溶液的平均值;
D.根据c= 计算出该氯化钾溶液的质量分数.
计算出该氯化钾溶液的质量分数.
解答: 解:A.硫酸钡的化学式为BaSO4,假设等体积的硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量均为233克,硫酸钡沉淀的物质的量为1mol,1mol硫酸钡含有1mol的硫酸根离子,等体积的硫酸铁、硫酸铜、硫酸钾溶液,根据化学方程式,Fe2(SO4)3的浓度为: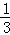 mol/L,CuSO4、K2SO4均需要1mol/L,则三种硫酸盐溶液的物质的量浓度之比为:
mol/L,CuSO4、K2SO4均需要1mol/L,则三种硫酸盐溶液的物质的量浓度之比为: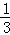 mol/L:1mol/L:1mol/L=3:1:1,故A错误;
mol/L:1mol/L:1mol/L=3:1:1,故A错误;
B.由反应2Na2O2+2H2O=4NaOH+O2↑、Na2O+H2O=2NaOH可知,过氧化钠与氧化钠溶于水,二者消耗的水的量相同,生成等物质的量的NaOH,所得溶液的物质的量浓度一定相等,故B错误;
C.由于氨水的密度小于1,所以质量分数分别为5%和15%的氨水等体积混合后,所得溶液的质量分数小于两溶液的平均值,即小于: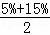 =10%,故C错误;
=10%,故C错误;
D.由c= 可得,ω=
可得,ω=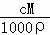 ×100%=
×100%=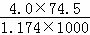 ×100%,故D正确;
×100%,故D正确;
故选D.
点评: 本题考查了溶质质量分数的计算、物质的量浓度与溶质质量分数的换算,题目难度中等,注意掌握物质的量浓度、溶质质量分数的概念及计算方法,选项C为易错点,注意密度小于1的溶液、密度大于1的溶液混合后的质量分数变化规律.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:
下列金属冶炼的反应原理中正确的是()
A. 2AlCl3(熔融)  2Al+3Cl2↑
2Al+3Cl2↑
B. MgO+H2 Mg+H2O
Mg+H2O
C. ZnO+CO  Zn+CO2
Zn+CO2
D. 2CuO  2Cu+O2↑
2Cu+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见图).下列说法正确的是()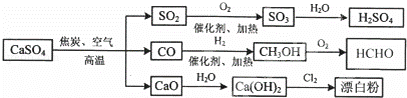
A. CO、SO2、SO3均是酸性氧化物
B. 除去与水反应,图示转化反应均为氧化还原反应
C. 工业上利用Cl2和澄清石灰水反应来制取漂白粉
D. 用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
10克Fe2O3、SiO2、Al2O3混合物加入足量的100mL x mol/L稀硫酸中,过滤,然后加入10mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液体积如右图.以下叙述错误的是()

A. 滤出的物质为SiO2 B. 可求出x的值
C. 可求出Al2O3的质量分数 D. 可求出Fe2O3的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物在生产和生活中有着广泛的应用.
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
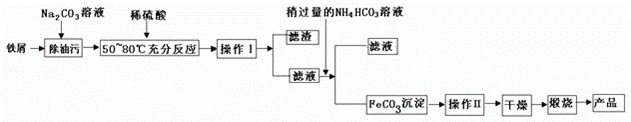
回答下列问题:
①操作Ⅰ、Ⅱ的名称分别是 、 .
②写出在空气中煅烧FeCO3的化学方程式 ;
③煅烧如果不充分,产品中将有Fe2+存在,试设计实验检验产品中有无Fe2+.
(2)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定.
a.称取2.850g绿矾(FeSO4•7H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式
②计算上述样品中FeSO4•7H2O的质量分数为 已知M(FeSO4•7H2O)=278g/mol]
③滴定达到终点时锥形瓶中溶液颜色变化为
④下列操作会导致样品中FeSO4•7H2O的质量分数的测定结果偏高的有 .
a.未干燥锥形瓶
b.盛装标准液的滴定管没有用标准液润洗
c. 滴定终点时滴定管尖嘴中产生气泡
d.量取待测液,视线注视刻度时开始平视、结束俯视.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于药品保存方法不正确的是( )
A. 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
B. 硅酸钠溶液应保存在带橡胶塞的试瓶中
C. 液溴易挥发,在存放溴的试剂瓶中应加水封
D. 浓硝酸存放在带有玻璃塞的棕色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:某温度下,Ksp(BaCO3)=5.1×10-9 mol2 • L-2;Ksp(BaSO4)= l.1×10-10 mol2 • L-2 下列推断正确的是
A.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C.若误饮c(Ba2+)= 1.0 ×10-5 mol • L﹣1的溶液时,会引起钡离子中毒
D.可以用0.36 mol • L﹣1的Na2SO4溶液给钡离子中毒患者洗胃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com