
NA代表阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,0.1NA个乙炔分子完全燃烧需要的O2的体积约为11.2L |
| B.标准状况下,11.2L乙烯分子中含有的碳碳共用电子对数目为0.5NA |
| C.15g乙烷分子中含有的碳氢键数目为3NA |
| D.常温常压下,1 mol氦气含有的核外电子数为4 NA |
C
解析试题分析:A.0.1NA个乙炔分子的物质的量为0.1mol,乙炔燃烧的方程式为:2C2H2+5O2 4CO2+2H2O.所以标准状况下,0.1NA个乙炔分子完全燃烧需要的O2的物质的量为0.25mol,其体积为体积约为5.6L.错误。B.标准状况下,11.2L乙烯分子的物质的量为0. 5mol.由于在每个乙烯分子中含有的碳碳共用电子对数目为2个,所以NA。错误。C.15g乙烷分子的物质的量为15g÷30g/mol=0.5mol.在每个乙烷分子中含有6个C—H键,所以0.5mol乙烷中含有的碳氢键数目为3NA。正确。D.氦气是单原子分子,He是2号元素,每个He原子有2个电子。所以常温常压下,1 mol氦气含有的核外电子数为2 NA.错误。
4CO2+2H2O.所以标准状况下,0.1NA个乙炔分子完全燃烧需要的O2的物质的量为0.25mol,其体积为体积约为5.6L.错误。B.标准状况下,11.2L乙烯分子的物质的量为0. 5mol.由于在每个乙烯分子中含有的碳碳共用电子对数目为2个,所以NA。错误。C.15g乙烷分子的物质的量为15g÷30g/mol=0.5mol.在每个乙烷分子中含有6个C—H键,所以0.5mol乙烷中含有的碳氢键数目为3NA。正确。D.氦气是单原子分子,He是2号元素,每个He原子有2个电子。所以常温常压下,1 mol氦气含有的核外电子数为2 NA.错误。
考点:考查阿伏加德罗常数在物质结构的计算中的应用的知识。


科目:高中化学 来源: 题型:单选题
对于相应化学用语的推论合理的是( )
| 选项 | 化学用语 | 推论 |
| A | 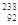 U3+ U3+ | 该铀离子核外有89个电子 |
| B | 2H2(g)+O2(g)=" " 2H2O(g);△H=-483.6kJ?mol | 1mol氢气完全燃烧放出热量483.6kJ. |
| C | 2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 2NaOH+H2↑+Cl2↑ | NaCl氧化性比Cl2强 |
| D | FeO+4H++NO3―= Fe3++NO2↑+2H2O | 氧化亚铁溶于稀硝酸的离子方程式 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NA表示阿伏加德罗常数,下列叙述正确的是
| A.Na2O和Na2O2的混合物共1mol,阴离子数目为NA |
| B.过量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.2NA |
| C.标准状况下,11.2 LCHCl3中含有C-Cl键的数目为1.5NA |
| D.一定条件下,2 mol H2和0.5 mol N2充分反应后可得到NH3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
8.34gFeS04·7H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示
| A.温度为78℃时固体物质M的化学式为FeSO4?5H2O |
| B.温度为l59℃时固体物质N的化学式为FeSO4?3H2O |
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4 FeO+SO3↑ FeO+SO3↑ |
| D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.在反应中消耗1mol Cl2,转移的电子数一定为2NA |
| B.标准状况下,0.5mol氦气含有的电子数为NA |
| C.15gCH3+(碳正离子)中含有电子数为10NA |
| D.0.1L 2 mol·L-1的(NH4)2S溶液中含有的S2-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.欲配制1.00L 1.00mol·L-1的NaCI溶液,可将58.5g NaC1溶于1.00L水中 |
| B.0.2mol Na2O2与足量水反应,转移电子数为0.4NA |
| C.同温同压下,质量相同的SO2气体和CO2气体的体积比等16:11 |
| D.1.0L 1.0mol ·L-l的Na2CO3水溶液中含有的氧原子数大于2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com