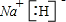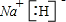����⣺X��Y��Z��W���ֶ�����Ԫ�ص�ԭ�Ӱ뾶���μ�С��X������������Ϊ������������2����Xԭ��ֻ����2�����Ӳ㣬����������Ϊ4����XΪCԪ�أ�W�ֱ�����X��Y��Z��һ��ԭ�������γɵ�������Ϊ10�ij������������֪WΪHԪ�أ������ڱ���X��Y��Y��Z��λͬһ���ڵ�����λ�ã����ԭ�Ӱ뾶��֪��YΪNԪ�ء�ZΪ��Ԫ�أ�
��1����CN��
2����������ԭ������㶼����8���ӣ�Cԭ����Nԭ��֮���γ�3�Թ��õ��Ӷԣ�Cԭ��֮���γ�1�Թ��õ��Ӷԣ���ṹʽΪ��N��C-C��N��
KCN��Һ��ʹ��̪��Һ�Ժ�ɫ��CN
-����ˮ��CN
-+H
2O?HCN+OH
-���ƻ�ˮ�ĵ���ƽ�⣬����Һ�ʼ��ԣ�ʹ��̪��Һ�Ժ�ɫ��
�ʴ�Ϊ��N��C-C��N��CN
-+H
2O?HCN+OH
-��
��2�������谷��N��C-NH
2���۵õ��������谷���Ǽ��Լ���N��C-NH
2��C��N��������һ��C-N�����ѣ�Cԭ����Nԭ�ӽ��������γɣ��������谷�Ľṹ��ʽΪ��
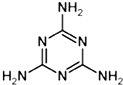
���ʴ�Ϊ��

��
��3��C
3H
6N
6ˮ���������������һ��������������������ᣬˮ�ⷴӦΪC
3H
6N
6+3H
2O=C
3N
3��OH��
3+3NH
3���ʴ�Ϊ��C
3H
6N
6+3H
2O=C
3N
3��OH��
3+3NH
3��
��4����֪���١�2CO
2��g��+2H
2O��l���TC
2H
4��g��+3O
2��g����H=+1411.0kJ/mol��
�ڡ�2CO
2��g��+3H
2O��l���TC
2H
5OH��l��+3O
2��g����H=+1366.8kJ/mol��
���ݸ�˹���ɣ���-�ٵ�C
2H
4��g��+H
2O��l���TC
2H
5OH��l����H=-44.2kJ/mol��
�ʴ�Ϊ��C
2H
4��g��+H
2O��l���TC
2H
5OH��l����H=-44.2kJ/mol��
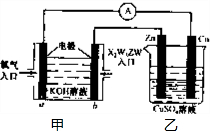
��5����ԭ�������������ԭ��Ӧ����������������Ӧ��C
2H
5OHȼ�ϵ��������������ͨ�롢�Ҵ��ڸ������룬��C
2H
5OHȼ�ϵ��װ��ͼ��֪��aΪԭ���������bΪԭ��ظ������ұ�װ��Ϊ��Ƴأ�Cu����ԭ���������Ϊ�������ʴ�Ϊ������
��bΪԭ��ظ������Ҵ�ʧȥ���ӣ���������������̼�����ˮ��b���ĵ缫��ӦʽΪ��C
2H
5OH+16OH
--12e
-=2CO
32-+11H
2O��
�ʴ�Ϊ��C
2H
5OH+16OH
--12e
-=2CO
32-+11H
2O��
�۵�ͭƬ�������仯Ϊ12.8gʱ�������ʵ���=
=0.2mol��Cu�缫��Ӧʽ��Cu-2e
-=Cu
2+����ת�Ƶ������ʵ���=0.2mol��2=0.4mol�����ݵ���ת���غ��֪��a�������ĵ�O
2�����ʵ���=
=0.1mol���ʱ�����������������Ϊ0.1mol��22.4L/mol=2.24L��
ԭ����ܷ�Ӧʵ��Ϊ���Ҵ�ȼ�����ɶ�����̼��ˮ��������̼�����������Ʒ�Ӧ����̼������ˮ��NaOH��Ũ�ȼ��ͣ���Һ���Լ������ʼ�װ������ҺpH��С��
�ұ�װ��Ϊ��Ƴأ�Cu����ԭ���������Ϊ������Zn����ԭ��ظ�����Ϊ�����������缫��ӦʽΪ��Cu-2e
-=Cu
2+�������缫��ӦʽΪ��Cu
2++2e
-=Cu���������Һ��Ũ�Ȳ��䣬����װ������ҺpH���䣬
�ʴ�Ϊ����С�����䣮

 ��֪X��Y��Z��W���ֶ�����Ԫ�ص�ԭ�Ӱ뾶���μ�С�������ڱ���X��Y��Y��Z��λͬһ���ڵ�����λ�ã�X������������Ϊ������������2����W�ֱ�����X��Y��Z��һ��ԭ�������γɵ�������Ϊ10�ij�����������ж�X��Y��Z��W����Ԫ�ز��ش��������⣺��Ҫ����ȷ�����Ԫ�ط��ż��йػ�ѧ�����ʾ��
��֪X��Y��Z��W���ֶ�����Ԫ�ص�ԭ�Ӱ뾶���μ�С�������ڱ���X��Y��Y��Z��λͬһ���ڵ�����λ�ã�X������������Ϊ������������2����W�ֱ�����X��Y��Z��һ��ԭ�������γɵ�������Ϊ10�ij�����������ж�X��Y��Z��W����Ԫ�ز��ش��������⣺��Ҫ����ȷ�����Ԫ�ط��ż��йػ�ѧ�����ʾ��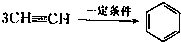 �����谷Ҳ�������谷��WXY�����е�Wԭ�ӱ�����ȡ����ɵ��谷��������������Ȳ�����۷�Ӧ���õ��������谷���Ǽ��Լ�������������������д�������谷�ṹ��ʽ��
�����谷Ҳ�������谷��WXY�����е�Wԭ�ӱ�����ȡ����ɵ��谷��������������Ȳ�����۷�Ӧ���õ��������谷���Ǽ��Լ�������������������д�������谷�ṹ��ʽ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��

 ��У����ϵ�д�
��У����ϵ�д�