
 CO(g)��H2(g) , �Է����ͻش��������⣺
CO(g)��H2(g) , �Է����ͻش��������⣺| A����ϵ��ѹǿ���ٷ����仯 |
| B��v��(CO)��v��(H2O) |
| C������n mol CO��ͬʱ����n mol H2 |
| D��1 mol H��H�����ѵ�ͬʱ����2 mol H��O�� |
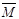 ��ȡֵ��Χ�� ��
��ȡֵ��Χ�� ��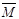 1�����ֱ����
1�����ֱ����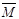 �ı仯�������������С���������䡱��
�ı仯�������������С���������䡱��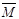 1��ȡֵ 1��ȡֵ | 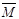 �ı仯 �ı仯 |
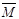 1��12 1��12 | |
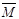 1��12 1��12 | ���� |
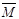 1��12 1��12 | |
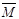 ��28��2�֣�
��28��2�֣�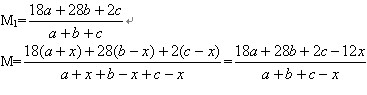


 ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ˮӦ�ܱձ��棬�õ��´� |
| B����FeCl2��Һ�м������۷�ֹ�������� |
| C������������ʹ�ù�����������߰��������� |
| D��ʵ�������ű���ʳ��ˮ���ռ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���ữѧʽ | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� | 1.8��10-5 | 4.9��10-10 | K1=4.3��10-7 K2=5.6��10-11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 N2O4��g�� ��H��298K��=-52.7kJ��mol-1��
N2O4��g�� ��H��298K��=-52.7kJ��mol-1��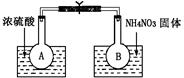
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
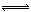 2 NH3(g)����H��-92.4 kJ��mol-1����������ȷ���ǣ� ��
2 NH3(g)����H��-92.4 kJ��mol-1����������ȷ���ǣ� ��| A���ﵽ��ѧƽ��ʱ�����������������������Ӧ���ʼ�С ���淴Ӧ�������� |
| B������λʱ��������x mol N2��ͬʱ������2x molNH3����Ӧ�ﵽƽ��״̬ |
| C���ﵽ��ѧƽ��ʱ��2v��(H2)��3v��(NH3) |
| D���������������Ӧ���������淴Ӧ���ʲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO2(g)��H2(g)
CO2(g)��H2(g) | ���� ��� | �¶� /�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ���ʱ��/min | ��ƽ��ʱ��ϵ�����ı仯/kJ | ||
| CO | H2O | CO2 | H2 | ||||
| �� | 650 | 1 | 2 | 0.4 | 0.4 | 5 | 16.4kJ |
| �� | 650 | 2 | 4 | | | t1 | Q1 kJ |
| �� | 900 | 2 | 4 | 1.6 | 1.6 | t2 | Q2 kJ |
 CO2(g)��H2(g) ��H����41 kJ/mol
CO2(g)��H2(g) ��H����41 kJ/mol�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
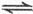 2Z��g����H<0����ͼ��ʾ�ӷ�Ӧ��ʼ��t
2Z��g����H<0����ͼ��ʾ�ӷ�Ӧ��ʼ��t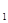 sʱ�ﵽƽ�⣬��t
sʱ�ﵽƽ�⣬��t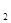 sʱ���������仯ʹƽ���ƻ�����t
sʱ���������仯ʹƽ���ƻ�����t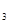 sʱ�ִ�ƽ�⡣����ͼ��t
sʱ�ִ�ƽ�⡣����ͼ��t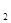 sʱ�ı������������
sʱ�ı������������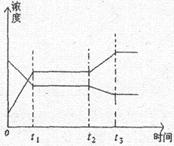
| A������ѹǿ |
| B��ʹ���˴��� |
| C�������¶� |
| D����С��X��Y��Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
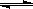 xC(g)��2minʱ��Ӧ����ƽ��״̬���¶Ȳ��䣩����ʱ������ʣ����0.8mol B,�����C��Ũ��Ϊ0.4mol��L-1������д���пհף�
xC(g)��2minʱ��Ӧ����ƽ��״̬���¶Ȳ��䣩����ʱ������ʣ����0.8mol B,�����C��Ũ��Ϊ0.4mol��L-1������д���пհף��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H2(g)��I2(g)����H��0����t1ʱ�ﵽƽ�⣬t2ʱ�������²����£���t3ʱ�ִﵽ��ƽ�⣬������һ�仯��ͼ����( )��
H2(g)��I2(g)����H��0����t1ʱ�ﵽƽ�⣬t2ʱ�������²����£���t3ʱ�ִﵽ��ƽ�⣬������һ�仯��ͼ����( )��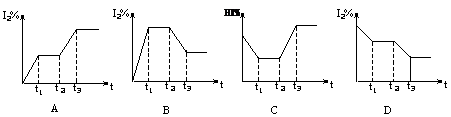
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com