
(14分)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)  (NH4)2CO3(aq)ΔH1
(NH4)2CO3(aq)ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)  NH4HCO3(aq)ΔH2
NH4HCO3(aq)ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)  2NH4HCO3(aq)ΔH3
2NH4HCO3(aq)ΔH3
请回答下列问题:
(1)ΔH3与ΔH1、ΔH2之间的关系是:ΔH3= 。
(2) 反应Ⅲ的化学平衡常数表达式为 。
(3)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①ΔH3 0(填“>”、“=”或“<”)。
②在T1~T2及T4~T5两个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是
。
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将该反应体系温度迅速上升到T2,并维持该温度。请在该图中画出t1时刻后溶液的pH变化总趋势曲线。
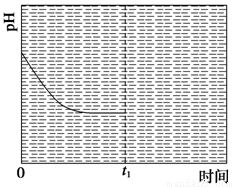
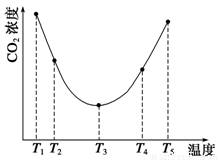
图1 图2
(4)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有
。
(5)下列物质中也可以作为CO2捕获剂的是 。
A.NH4Cl B.Na2CO3 C.HOCH2CH2OH D.HOCH2CH2NH2
(1)2ΔH2-ΔH1 (2) K=c2 (NH4HCO3) /{c [(NH4)2CO3)]·c(CO2)}
(3)①< ②T1~T2区间,化学反应未达到平衡,温度越高,化学反应速率越快,所以CO2被捕获的量随温度升高而提高。T4~T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2捕获
③ (4)降低温度,增加CO2浓度(或分压) (5)BD
(4)降低温度,增加CO2浓度(或分压) (5)BD
【解析】
试题分析:(1)将反应Ⅰ倒过来书写:(NH4)2CO3 (aq) 2NH3 (l)+H2O (l)+CO2 (g)-△H1,将反应Ⅱ×2:2NH3 (l)+2H2O (l)+2CO2 (g)
2NH3 (l)+H2O (l)+CO2 (g)-△H1,将反应Ⅱ×2:2NH3 (l)+2H2O (l)+2CO2 (g) 2NH4HCO3 (aq) 2△H2,得:(NH4)2CO3 (aq)+H2O (l)+CO2 (g)
2NH4HCO3 (aq) 2△H2,得:(NH4)2CO3 (aq)+H2O (l)+CO2 (g) 2NH4HCO3 (aq)△H3=2△H2-△H1 。
2NH4HCO3 (aq)△H3=2△H2-△H1 。
(2)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此反应Ⅲ的化学平衡常数表达式为K=c2 (NH4HCO3) /{c [(NH4)2CO3)]·c(CO2)}。
(3)①由图1可知:在温度为T3时反应达平衡,此后温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应△H3<0。
②T1~T2区间,化学反应未达到平衡,温度越高,化学反应速率越快,所以CO2被捕获的量随温度升高而提高。T4~T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2捕获。
③反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡,图象应为,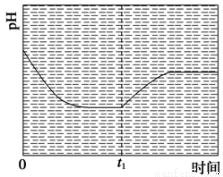 。
。
(4)根据平衡移动原理,降低温度或增大c(CO2)。
(5)具有碱性的物质均能捕获CO2,反应如下:Na2CO3+CO2+H2O=2NaHCO3;HOCH2CH2NH2+CO2+H2O=HOCH2CH2NH3++HCO3-;故答案为B、D。
考点:考查热化学方程式书写,化学反应速率、化学平衡移动和化学方程式书写等


科目:高中化学 来源:2013-2014江苏省海门市第一学期期末教学质量调研高一化学试卷(解析版) 题型:选择题
对1 mol/L的BaCl2溶液的有关叙述中,正确的是
A.该溶液中Cl-浓度为0.5 mol/L
B.该溶液中Ba2+的物质的量是1 mol
C.该溶液中Ba2+和Cl-的物质的量之比为1:2
D.将208 g BaCl2固体溶解在1 L水中,所得溶液的浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列叙述错误的是
A.乙烯和苯都能使溴水褪色,褪色的原理相同
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D.乙醇、乙酸、乙酸乙酯都能发生取代反应。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一期末模拟化学试卷(解析版) 题型:选择题
下列表述正确的是
①开发使用新型清洁能源,减少化石燃料的燃烧,可从根本上防止酸雨的产生 ②我国从2000年起逐渐用二氧化氯取代氯气对饮用水进行消毒,因为二氧化氯杀菌、消毒能力强,持效长 ③氧化镁可用来制造耐火砖和坩埚等④明矾能使水中的悬浮物凝聚,可做为净水剂 ⑤建设三峡大坝使用了大量水泥,水泥是硅酸盐材料 ⑥给机动车安装尾气净化器,可减少光化学烟雾的发生
A.①④⑤ B.①②④⑤ C.②③④⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
常温下,含a mol CH3COOH和b mol NaOH的两溶液混合后,下列推论不正确的是
A.若a≤b,混合液的pH一定小于7
B.若a=2b,则混合液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
C.混合液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-)一定成立
D.当混合液的pH>7时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)一定成立
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | H2O2、SO2都能使酸性高锰酸钾褪色 | 前者表现出还原性后者表现出漂白性 |
B | 纯银器表面在空气中渐渐变暗 | 发生了化学腐蚀 |
C | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
D | BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 | 说明Ksp(BaSO4)大于Ksp(BaCO3) |
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是
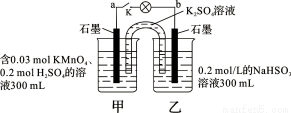
A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小
D.乙池中的氧化产物为SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A. 在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(OH-)减小
B. 反应Hg(l)+H2SO4(aq)===HgSO4(aq)+H2(g)在常温下不能自发进行,则ΔH<0
C. 工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应
D. 在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com