
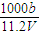
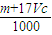
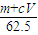
 )m<p<(
)m<p<(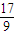 )m
)m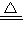 MgO+H2O;2Al(OH)3
MgO+H2O;2Al(OH)3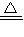 Al2O3+3H2O;
Al2O3+3H2O;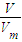 计算氢气的物质的量,根据电荷守恒,氢氧化镁、氢氧化铝沉淀中含有n(OH-),等于金属提供的电子的物质的量,等于生成氢气的获得的电子的物质的量,据此计算氢氧根离子的物质的量,再根据c=
计算氢气的物质的量,根据电荷守恒,氢氧化镁、氢氧化铝沉淀中含有n(OH-),等于金属提供的电子的物质的量,等于生成氢气的获得的电子的物质的量,据此计算氢氧根离子的物质的量,再根据c=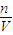 计算氢氧化钾的物质的量浓度;
计算氢氧化钾的物质的量浓度;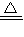 MgO+H2O,2Al(OH)3
MgO+H2O,2Al(OH)3 Al2O3+3H2O可知,沉淀灼烧生成氧化镁与氧化铝,二者质量等于金属质量与氧原子的质量之和,由方程式可知氧原子的物质的量等于氢氧根离子物质的量的一半,据此计算;
Al2O3+3H2O可知,沉淀灼烧生成氧化镁与氧化铝,二者质量等于金属质量与氧原子的质量之和,由方程式可知氧原子的物质的量等于氢氧根离子物质的量的一半,据此计算; ×2=cmol/L×V×10-3L,整理得c=
×2=cmol/L×V×10-3L,整理得c=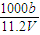 ,故A正确;
,故A正确;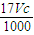 ,故B错误;
,故B错误;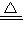 MgO+H2O,2Al(OH)3
MgO+H2O,2Al(OH)3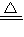 Al2O3+3H2O可知,氧化物的质量等于金属质量与氧原子的质量之和,由方程式可知氧原子的物质的量等于氢氧根离子物质的量的一半,故p=m+c×V×10-3×
Al2O3+3H2O可知,氧化物的质量等于金属质量与氧原子的质量之和,由方程式可知氧原子的物质的量等于氢氧根离子物质的量的一半,故p=m+c×V×10-3× ×16=m+
×16=m+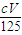 ,故C错误;
,故C错误;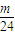 ×40=
×40=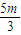 ,若mg全是铝,得到的氧化物为氧化铝,根据元素守恒,则质量为p=
,若mg全是铝,得到的氧化物为氧化铝,根据元素守恒,则质量为p=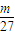 ×
× ×102=
×102=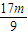 ,质量介于二者之间,故D正确;
,质量介于二者之间,故D正确;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A. ![]()
B.![]()
C.n=m+17Vc
D.![]()
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省忻州一中高一12月月考化学试卷(带解析) 题型:单选题
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
A. | B. |
| C.n=m+17Vc | D. m< m< < <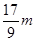 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com